Дженнифер Дудна — известная ученая из США, труды которой в основном посвящены структурной биологии и биохимии. Дженнифер лауреатка многих престижных премий, в 1985 году получила степень бакалавра, а уже в 89 году стала доктором философии в Гарвардском университете. С 2002 года работает в Калифорнийском университете в Беркли. Широкую известность получила как исследователь РНК-интерференции и CRISPR. Исследования по Cas9 проводила вместе с Эммануэль Шарпантье.
00:12
Несколько лет назад мы с моей коллегой Эммануэль Шарпентье изобрели новую технологию редактирования геномов. Она называется CRISPR-Cas9. Технология CRISPR позволяет учёным вносить изменения в ДНК внутри клеток, что может дать нам возможность вылечивать генетические заболевания.
00:31
Возможно, вам будет интересно узнать, что технология CRISPR возникла в рамках проекта фундаментальных исследований, целью которого было выяснение того, как бактерии борются с вирусными инфекциями. Бактериям приходится сталкиваться с вирусами в среде своего обитания, и вирусную инфекцию можно представить как тикающую бомбу замедленного действия: у бактерии есть всего несколько минут, чтобы её обезвредить до того как бактерия будет разрушена. В клетках многих бактерий существует адаптивная иммунная система - CRISPR, позволяющая им выявлять и разрушать вирусную ДНК.
01:04
В состав системы CRISPR входит белок Cas9, который способен искать, расщеплять и в конечном итоге уничтожать вирусную ДНК особым способом. И именно в ходе нашего исследования по изучению активности этого белка, Cas9, мы поняли, что можем использовать его активность в генно-инженерной технологии, которая позволит учёным удалять и вставлять фрагменты ДНК внутрь клеток с невероятной точностью, что позволило бы делать то, что ранее было просто невозможно.
01:42
Технология CRISPR уже используется для изменения ДНК в клетках мышей и обезьян, а также других организмов. Недавно китайские учёные показали, что им удалось использовать технологию CRISPR даже для изменения генов эмбрионов человека. Учёные из Филадельфии показали возможность применения CRISPR для удаления ДНК интегрировавшегося вируса ВИЧ из инфицированных клеток человека.
02:09
Возможность осуществлять редактирование генома таким образом также вызывает различные этические вопросы, которые следует иметь в виду, потому что технологию можно применять не только к клеткам взрослых, но также и к эмбрионам разных организмов, в том числе и нашего вида. Таким образом, вместе с коллегами мы начали международное обсуждение изобретённой нами технологии, чтобы иметь возможность учесть все этические и общественные проблемы, связанные с подобными технологиями.
02:39
А сейчас я хочу рассказать вам, что такое технология CRISPR, что она позволяет делать, на каком мы сейчас этапе и почему я считаю, что нам нужно с осторожностью продвигаться вперёд по пути применения этой технологии.
02:54
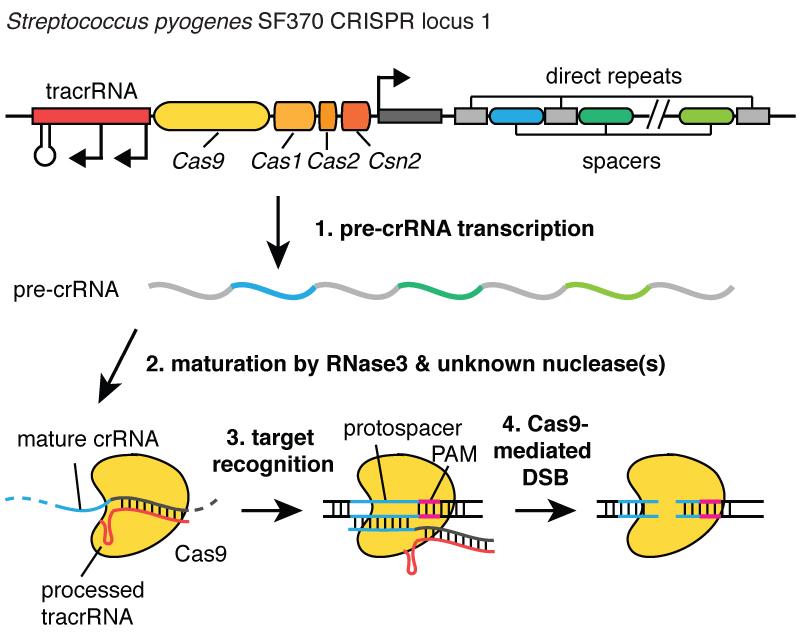
Когда вирусы инфицируют клетку, они впрыскивают свою ДНК. И внутри бактерии система CRISPR позволяет выдернуть эту ДНК из вируса и вставить её маленькие фрагменты в хромосому - в ДНК бактерии. И эти фрагменты вирусной ДНК вставляются в область, называемую CRISPR. CRISPR означает «короткие палиндромные повторы, регулярно расположенные группами». (Смех)
03:24
Длинновато. Теперь вы понимаете, почему мы используем акроним CRISPR. Это механизм, позволяющий клеткам регистрировать с течением времени вирусы, которые их заражали. И важно отметить, что эти фрагменты ДНК передаются потомкам клеток, так что клетки защищены от вирусов не в течение одного поколения, а в течение многих поколений клеток. Это позволяет клеткам сохранять «записи» об инфекции, и как говорит мой коллега Блейк Виденхефт, локус CRISPR - это фактически карточка генетической вакцинации клеток. После встраивания этих фрагментов ДНК в бактериальную хромосому клетка делает маленькую копию в виде молекулы, называемой РНК, на этом рисунке она оранжевая, и это точный отпечаток вирусной ДНК. РНК - химическая «кузина» ДНК, что позволяет ей взаимодействовать с молекулами ДНК, имеющими подходящую для неё последовательность.
04:24
Итак, эти маленькие фрагменты РНК, образованные с локуса CRISPR, ассоциируют, связываются с белком под названием Cas9, на этом рисунке он белый, и образуется комплекс, который выполняет в клетке функции часового. Он просматривает всю ДНК в клетке, чтобы найти участки, соответствующие последовательностям связанных с ним РНК. И когда эти участки найдены, как можно видеть на рисунке, где ДНК - это синяя молекула, этот комплекс связывается с этой ДНК и даёт белку Cas9 разрезать вирусную ДНК. Он очень точно вносит разрыв. Мы можем рассматривать этого часового, комплекс белка Cas9 и РНК, как пару ножниц, которые могут разрезать ДНК, - он делает двуцепочечный разрыв в спирали ДНК. И важно, что этот комплекс можно запрограммировать, например, можно его запрограммировать узнавать нужные последовательности ДНК и разрезать ДНК в на этом участке.
05:26
Как я собираюсь вам рассказать, мы поняли, что эту активность можно использовать в генной инженерии, чтобы позволить клеткам вносить очень точные изменения в ДНК на участке, где был сделан данный разрез. Это примерно как использование программы, обрабатывающей слова, для исправления опечаток в документе.
05:48
Мы смогли предположить, что систему CRISPR можно использовать в геномной инженерии, поскольку клетки способны находить разорванную ДНК и восстанавливать её. Итак, когда клетка растения или животного находит двуцепочечный разрыв в своей ДНК, она способна его устранить, либо соединяя разорванные концы ДНК, внося незначительное изменение в последовательность в этом месте, либо она может устранить разрыв, вставив новый участок ДНК в место разрыва. Таким образом, если мы можем вносить двуцепочечные разрывы в ДНК в строго определённых местах, мы можем заставить клетки восстанавливать эти разрывы, при этом либо разрушая генетическую информацию, либо внося новую. И если бы мы смогли запрограммировать технологию CRISPR таким образом, чтобы разрыв в ДНК вносился в положении мутации или рядом с мутацией, вызывающей, например, муковисцидоз, мы могли бы заставить клетки исправить эту мутацию.
06:51
Вообще-то, геномная инженерия - не новая область, она развивается с 1970-х годов. У нас есть технологии для секвенирования ДНК, для копирования ДНК, даже для манипуляций с ДНК. И это весьма многообещающие технологии, но проблема в том, что они были либо неэффективны, либо слишком сложны в использовании, поэтому большинство учёных не могли использовать их в своих лабораториях или применять в клинических условиях. Таким образом, существовала потребность в такой технологии как CRISPR, потому что она относительно проста в использовании. Старые технологии геномной инженерии можно представить себе как необходимость перемонтировать ваш компьютер каждый раз, когда вы хотите запустить новую программу, тогда как технология CRISPR - это что-то вроде программного обеспечения для генома: мы легко можем её программировать, используя маленькие фрагменты РНК.
07:53
Как только сделан двуцепочечный разрыв, мы можем вызвать процесс восстановления и тем самым, возможно, достичь поразительных результатов, например, исправлять мутации, вызывающие серповидноклеточную анемию или болезнь Хантингтона. Лично я считаю, что первые случаи применения технологии CRISPR будут связаны с кровью, где относительно просто доставлять этот инструмент внутрь клеток, по сравнению с плотными тканями.
08:22
Прямо сейчас во многих проводимых работах метод применяют в животных моделях болезней человека, например, на мышах. Технологию используют для внесения очень точных изменений, что позволяет нам изучать то, как эти изменения клеточной ДНК влияют либо на ткань, либо, как здесь, на целый организм.
08:42
В этом примере технологию CRISPR использовали для разрушения гена путём внесения небольшого изменения в ДНК в гене, который отвечает за чёрную окраску шерсти этих мышей. Представьте, эти белые мышата отличаются от своих окрашенных братьев и сестёр всего только небольшим изменением одного гена во всём геноме, а в остальном они абсолютно нормальны. И когда мы секвенируем ДНК этих животных, то обнаруживаем, что изменение в ДНК произошло именно в том месте, где мы планировали, используя технологию CRISPR.
09:18
Также проводятся эксперименты и на других животных, у которых удобно создавать модели болезней человека, например, на обезьянах. И в этом случае мы обнаруживаем, что эти системы можно использовать для тестирования применения данной технологии к определённым тканям, например, для выяснения того, как доставлять инструмент CRISPR в клетки. Мы также хотим расширить наше понимание того, как можно контролировать способ восстановления ДНК после её разрыва, и выяснить, как можно контролировать и ограничивать нецелевое воздействие, или непреднамеренные эффекты, при использовании этой технологии.
09:55
Я полагаю, что мы станем свидетелями использования данной технологии в клинике, разумеется, у взрослых пациентов, в течение следующих 10 лет. Мне кажется вероятным, что за этот период будут проведены клинические исследования и, возможно, даже одобрены методы терапии, что очень воодушевляет. И благодаря этому воодушевлению, которое вызывает технология, к ней проявляют огромный интерес стартап-компании, созданные для того, чтобы превратить технологию CRISPR в коммерческий продукт, а также многие венчурные капиталисты,
10:26
инвестирующие в такие компании. Но мы также должны учитывать, что технологию CRISPR можно использовать для улучшения характеристик. Представьте, что мы могли бы попробовать конструировать людей, обладающих улучшенными характеристиками, например, более прочными костями, или меньшей склонностью к сердечно-сосудистым заболеваниям, или даже обладающих свойствами, которые, возможно, показались бы нам желательными, такими как другой цвет глаз или более высокий рост, что-то вроде этого. Если хотите, это «дизайнерские люди». Сейчас практически отсутствует генетическая информация, позволяющая понять, какие гены отвечают за эти признаки. Но важно понимать, что технология CRISPR дала нам инструмент для внесения таких изменений,
11:13
как только эти знания станут нам доступны. Это поднимает ряд этических вопросов, которые мы должны тщательно рассмотреть. И именно поэтому мы с коллегами призвали учёных всего мира сделать паузу в любых клинических применениях технологии CRISPR у эмбрионов человека, чтобы у нас было время тщательно рассмотреть все возможные последствия этого. И у нас есть важный прецедент для того, чтобы объявить такую паузу: в 1970-х годах учёные объединились для провозглашения моратория на использование молекулярного клонирования,
11:47
пока не будет тщательно проверена и подтверждена безопасность этой технологии. Так что пока генная инженерия людей откладывается, но это уже не научная фантастика. Созданные генной инженерией животные и растения уже существуют. И это накладывает на всех нас большую ответственность и необходимость учитывать как нежелательные последствия, так и роль преднамеренного влияния этого научного прорыва.
12:21
Спасибо!
12:22
(Аплодисменты) (Аплодисменты закончились)
Бруно Джуссани: Дженнифер, эта технология может иметь огромные последствия, как вы подчёркивали. Мы очень уважаем вашу позицию по объявлению паузы, или моратория, или карантина. У всего этого, конечно, есть терапевтические последствия, но есть и не связанные с лечением, и, по-видимому, именно они наиболее сильно притягивают интерес, особенно в СМИ. Вот один из последних выпусков журнала Economist: «Редактирование человечества». Здесь рассказывается только об улучшении свойств, не о лечении. Какую реакцию вы получили в марте от своих коллег в научном сообществе, когда попросили или предложили сделать паузу и задуматься обо всём этом?
Дженнифер Дудна: Мне кажется, коллеги были рады возможности открыто это обсудить. Интересно, что когда я разговаривала об этом с людьми, мои коллеги-учёные и не только высказывали самые разные точки зрения на этот счёт. Очевидно, что эта тема требует тщательного рассмотрения и обсуждения.
БДж: В декабре будет большая встреча, которую вы с коллегами созываете вместе с Национальной академией наук и другими. Чего именно вы ожидаете от этой встречи, с практической точки зрения?
ДжД : Я надеюсь, что будут обнародованы точки зрения многих людей и заинтересованных сторон, желающих ответственно обдумать использование этой технологии. Возможно, достигнуть консенсуса не удастся, но я полагаю, что мы должны по крайней мере понять, с какими проблемами столкнёмся в будущем.
БДж: Ваши коллеги, например, Джордж Чёрч из Гарварда, говорят: «Этические проблемы в основном являются вопросом безопасности. Мы снова и снова проводим тесты на животных, в лабораториях, и когда чувствуем, что опасности нет, переходим на человека». Это другой подход: мы должны использовать эту возможность и не должны останавливаться. Может ли это вызвать раскол в научном сообществе? То есть мы увидим, что часть людей отступят, потому что сомневаются в этичности, а другие просто пойдут вперёд, так как в некоторых странах контроль слабый или его вообще нет.
ДжД : Мне кажется, на любую новую технологию, особенно такую как эта, будет несколько разных точек зрения, и я думаю, что это абсолютно понятно. Полагаю, в конце концов эту технологию будут использовать для конструирования генома человека, но мне кажется, что делать это без тщательного рассмотрения и обсуждения рисков и возможных осложнений было бы безответственно.
БДж: Есть много технологий и других областей науки, которые развиваются по экспоненте, фактически как в вашей области. Я имею в виду искусственный интеллект, автономных роботов и так далее. Нигде, как мне кажется, кроме области автономных военных роботов, никто не инициировал аналогичную дискуссию в этих областях, призвав к мораторию. Не считаете ли вы, что ваша дискуссия может стать примером для других областей?
ДжД: Мне кажется, учёным сложно покидать лабораторию. Если говорить обо мне, мне не очень комфортно это делать. Но я действительно считаю, что раз я участвую в разработке этого, то данный факт накладывает на меня и моих коллег ответственность. И я бы сказала, что надеюсь, что другие технологии будут рассматриваться так же, как мы хотели бы рассматривать нечто, способное оказывать влияние в других областях, отличных от биологии.
15:44
БДж:
Дженнифер, спасибо за то, что пришли на TED.
ДжД : Спасибо!
ДНК - это химическое вещество, которое подвержено внешнему влиянию. Эти влияния могут быть физическими (температура, ультрафиолетовое и радиационное излучение) или химическими (свободные радикалы, канцерогены и т. п.).
Температура
При повышении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2 раза. Конечно, в клеточном ядре (там, где хранится ДНК) нет таких перепадов температуры. Но есть небольшие изменения, которые могут привести к тому, что ДНК прореагирует с каким-нибудь веществом, растворенным неподалеку.
УЛЬТРАФИОЛЕТ
Ультрафиолет действует на нас почти всегда. Зимой это ничтожные дозы. Летом - значительные. Если ультрафиолетовый фотон попадает в молекулу ДНК, его энергии хватает для образования новой химической связи. Соседние звенья ДНК (нуклеотиды) могут образовать дополнительную связь друг с другом, что приведет к нарушению считывания и репликации ДНК. Или же УФ фотон может привести в разрыву нити ДНК из-за своей высокой энергии.
РАДИАЦИЯ
Радиационное излучение. Вы думаете, оно только на реакторе? Есть так называемый нормальный радиационный фон, то есть вокруг и через нас каждую секунду пролетает несколько частиц, и не всегда это происходит бесследно для нашей ДНК. Чтобы понять масштабность радиационного фона, посмотрите .
Но не стоит бояться. Фон не зря назван нормальным. Далеко не все частицы проходят через кожу, из проникнувших не все проникают глубоко, а те, что проникли, часто врезаются в другие молекулы и атомы в клетке, которых очень много. Лишь единицы добираются до ДНК, и то могут не оказать никакого эффекта на нее.
Кстати, чем выше над землей, тем радиационный фон ярче. Связано это с космической радиацией, от которой нас в большей степени защищает магнитное поле земли и атмосфера. Чем дальше от земли, тем магнитное поле слабее и слой атмосферы тоньше, и большее число высокоэнергетических частиц бомбардируют наше тело.
СВОБОДНЫЕ РАДИКАЛЫ
Среди химических бОльшая роль отводится именно свободным радикалам, которые постоянно образуются в клетке. Это побочный продукт окислительно-восстановительных процессов, без которых невозможна жизнь. Конечно, за миллионы лет эволюции выжили только те организмы, у которых возникла система нейтрализации свободных радикалов. У нас она тоже есть. Но ничто не работает со 100% эффективность, и нет-нет, да несколько радикалов умудряются повредить ДНК.
Кстати о радиации. Она также ответственна за образование свободных радикалов. Те высокоэнергетические частицы, которые прореагировали с веществами, окружающими ДНК, часто приводят в образованию радикалов.
КАНЦЕРОГЕНЫ
Что касается канцерогенов, то хорошим примером является бензпирен - вещество, образующееся при горении угля и углеводородов, например бензина. Он содержится в выхлопных газах и дыме от костра. Безпирен имеет высокое сродство к ДНК и встраивается в структуру ДНК, нарушая тем самым последовательность нуклеотидов. Есть и другие механизмы повреждения ДНК.
Внешними воздействиями причины не ограничены. Внутренняя кухня тоже не без изъяна. ДНК - динамичная молекула, которая часто удваивается, постоянно распутывается и спутывается, меняет свое положение в пространстве. Не все из этих процессов проходят гладко, и могут возникать разрывы нити ДНК, перестановка и даже потеря участков цепи, слияние нескольких молекул в одну. При делении клетки не все хромосомы могут поспеть за вновь образующимися клетками, и у одной из дочерних клеток может оказаться меньше хромосом, а у другой больше. Это тоже мутация.
Удвоение ДНК тоже происходит не точь-в-точь, а с ошибками. Более того, каждая копия немного короче оригинала, потому что края (теломеры) сложно скопировать. Рано или поздно (когда мы уже старые) теломеры укорачиваются настолько, что в "под нож" попадают кодирующие участки ДНК.
Все это звучит страшно, но во-первых, часто мутации являются безразличными и редко имеют негативные последствия, во-вторых в ходе эволюции возник механизм починки повреждений ДНК, который неплохо справляется со своими обязанностями, а в-третьих, мутационный процесс необходимый компонент для эволюции и позволяет появиться на свет тому, чего в природе еще не было.
Генная инженерия человека нам, простым обывателям, все еще кажется чем-то из области научной фантастики. Тем неожиданней было сообщение издания «The Telegraph», в котором говорилось, что Совет по этике в Великобритании разрешил генную инженерию человеческих эмбрионов. Понятно, что от рекомендаций Совета по этике до закона о генетических вмешательствах «дистанция огромного размера», однако первый шаг, похоже, сделан.
« The Telegraph» обратился за комментарием к профессору Карен Юнг, председателю рабочей группы по редактированию генома и воспроизводству человека. Госпожа профессор заявила, что в будущем в числе репродуктивных технологий может оказаться и внесение наследуемых изменений генома для обеспечения определенных характеристик детей. Сперва, разумеется, таким способом будут бороться с наследственными заболеваниями, но потом «если технология будет успешно развиваться, у нее есть потенциал стать альтернативной репродуктивной стратегией, доступной родителям для достижения более широкого круга целей».
На вопрос, можно ли использовать генетическое редактирование, чтобы дети были высокими, со светлыми волосами и голубыми глазами (ну, если вдруг именно такая внешность будет в моде), профессор Йонг добавила что и этого она тоже не исключает…
Но у нас возник не этический, а, если так можно выразиться, технический вопрос: неужели ученые уже в состоянии переделать нам геном и заменить голубые глаза на карие?
Что такое геном человека (для тех, кто прогулял уроки биологии)
Вся наша жизнь закодирована в молекулах ДНК - дезоксирибонуклеиновой кислоты. Удивительно, но все эти огромные молекулы состоят из комбинации всего лишь четырех основных элементов: азотистых оснований аденина, гуанина, тимина и цитозина (их обычно для краткости обозначают первыми буквами - A, G, T, C). Сложные последовательности этих элементов служат своеобразными матрицами, на которых синтезируются РНК - рибонуклеиновые кислоты. РНК - «рабочие лошадки» нашего организма, у каждой - своя специализация. Одни участвуют в синтезе белков, задавая верную последовательность элементов, другие поставляют аминокислоты к месту синтеза белков, третьи - «перекраивают» своих собратьев, катализируя реакции с участием РНК.
” Лично мне наш геном напоминает муравейник: с ДНК - муравьиной королевой, бесконечно откладывающей яйца, из которых появляются РНК-муравьи, среди которых есть солдаты, няньки, рабочие…
А в Википедии приводят такой пример: «ДНК нередко сравнивают с чертежами для изготовления белков. Развивая эту инженерно-производственную аналогию, можно сказать, что, если ДНК — это полный набор чертежей для изготовления белков, находящийся на хранении в сейфе директора завода, то матричная РНК — временная рабочая копия чертежа отдельной детали, выдаваемая в сборочный цех».
Выбирайте аналогию по своему вкусу!
Молекулы ДНК есть в любой клетке нашего организма, в которой есть ядро. Молекулы - потому что знаменитые спирали ДНК «нарублены» на 46 различных по размеру «кусков», соединенных попарно - это 23 пары наших хромосом.
” В каждой паре хромосом одна досталась нам от отца, а другая от матери. 23-я пара отвечает за наш пол, поэтому хромосомы в ней могут отличаться: «ХХ» - у девочек, «ХУ» - у мальчиков.
Во всех аутосомах (не-половых хромосомах) и хромосома, доставшаяся от папы, и доставшаяся от мамы, содержат подобные гены на одних и тех же участках. Подобные - поскольку гены, у всех нас, вообще говоря, разные. К примеру, на участке, где располагается ген, ответственный за цвет волос, в одной хромосоме из пары окажется ген мамы-блондинки, а на другой - папы-брюнета. В таком случае один из генов будет доминировать, а второй, рецессивный, ждать своего часа. Если именно его передадут по наследству, и если в паре с ним окажется такой же рецессивный ген, то у него будет возможность проявить себя.
” Этот принцип наследования генетической информации чреват неприятными сюрпризами. И мы сейчас вовсе не о рождении голубоглазого блондина в семье кареглазых брюнетов, а о наследственных заболеваниях. Порой, скрытые в рецессивных генах, они дремлют во многих поколениях, никак не проявляя себя внешне. Но стоит такому гену встретиться со своим «собратом», и трагические последствия неизбежны.
Любые родители хотели бы вырезать зловредный ген из своей ДНК и заменить его на здоровый, обезопасив потомков. И тут мы снова возвращаемся к вопросу: неужели это реально?
Генная инженерия и ЭКО
Светлана Владимировна, генетический анализ во время проведения экстракорпорального оплодотворения, «зачатия в пробирке», вещь уже привычная?
” -Доказано, что такое «отщипывание» клеток не приводит к нарушению развития зародыша. Этот метод технически гораздо сложнее и дороже, чем просто генетический анализ плода во время беременности, который проводится после забора амниотической жидкости или фрагмента плаценты, поэтому широкого распространения пока не получил.
То есть, родителям остается только уповать, что однажды случайным образом «выпадет» комбинация здоровых генов. А нельзя ли как-то вырезать «плохие» гены?
Ген удалять в большинстве случаев не надо, собственно, патогенные мутации как раз «удаляют» ген функционально. Надо заставить неправильно функционирующий ген работать нормально. Либо вырезать из него лишнее, либо вставить потерянное, либо заменить неправильное на правильное. Более простой подход - одним махом добавить в геном нормальную копию гена.
|
Своя собственная ДНК есть у митохондрий - органелл, отвечающих за «энергоснабжение» клетки. В отличие от остальных хромосом, находящихся в ядре, митохондриальные ДНК - это небольшие кольцевые молекулы, их количество в клетке варьирует от десятков до тысяч копий и зависит от возраста. Яйцеклетка богата митохондриями, а сперматозоид содержит всего одну, обеспечивающую движение его «хвостика». После оплодотворения эта митохондрия уничтожается, поэтому все митохондриальные гены человека достаются ему только от матери. Если причина заболевания находится в митохондриальной ДНК, то возможно использование митохондрий «третьего родителя». При этом ядро яйцеклетки матери, имеющей патогенные мутации, пересаживают в цитоплазму яйцеклетки женщины с нормальными митохондриями, а потом оплодотворяют её сперматозоидами отца и подсаживают по протоколу ЭКО. В частности, метод цитоплазматической замены успешно использовался в случае материнского бесплодия, связанного с нарушениями в митохондриальной ДНК. С 2015 г. этот метод генетической «модификации» человека легализован в Великобритании, но по-прежнему запрещён в США. Законодательство Австралии готовится к новшествам относительно генной инженерии. Чтобы обойти существующие запреты, такие манипуляции проводят на территории стран, где нет соответствующего законодательства, например в Мексике и на Украине.
|
Технологии изменения ДНК человека
- Но как можно «оперировать» ген, неужели речь идет о реальных технологиях?
Есть много способов разрезать молекулу ДНК. Инструменты для этого люди позаимствовали у бактерий. Борясь за место под солнцем (или, наоборот, в тени) бактерии синтезируют белки или комплексы белков и РНК, которые разрезают ДНК других видов бактерий и вирусов, но безвредны для ДНК хозяйки и её потомков. Эти молекулы прикрепляются к специфическим последовательностям ДНК (специфической фразе из «букв» А, С, T и G), которых заведомо нет в геноме хозяйки. Так что «отщипнуть» - не проблема, главное - правильно сшить обратно разрезанную молекулу. Если этого не сделать, то произойдёт разрыв хромосомы и нарушение функций того участка, где находится разрыв.
” - Сейчас наиболее перспективным орудием генного инженера считается бактериальная система CRISPR /Cas9 - часть иммунитета бактерий, модификации которой активно используют для редактирования геномов эукариот (живых организмов, клетки которых содержат ядра - прим. ред.). Бактерии «держат про запас» у себя в геноме фрагменты ДНК вирусов, с которыми они сталкивались раньше. Эти фрагменты позволяют бактерии быстро строить конструкции, состоящие из РНК и белков, которые специфически разрезают ДНК вирусов. При этом белок Cas9 функционирует как молекулярные ножницы, а так называемая gРНК, частично содержащая генетическую последовательность вируса, - это система GPS-навигации, которая направляет «ножницы» на специфический район ДНК. Бактерии борются с генами вирусов, но такой биотехнологический инструмент можно нацелить на произвольный участок ДНК любого организма.
Чтобы клетка, ДНК которой разрезали таким способом, смогла восстановиться, в неё параллельно вводят ДНК с нужной последовательностью. Клетка запускает собственные механизмы починки ДНК и использует добавленную ДНК как матрицу для починки полученного повреждения. Таким образом, можно поменять одну генетическую последовательность на другую!

- Где же берут «правильные» гены?
Практически любой ген человека можно вставить в геном бактерии, заставить эту бактерию активно делиться, а потом снова выделить нужный фрагмент в большом количестве. Так, сложные животные белки уже давно не выделяют из органов животных, а нарабатывают с помощью встроенных в бактерии генов (например, инсулин).
Может ли генная инженерия подарить здоровье и карие глаза
- То есть, генная инженерия возможна - пусть и в порядке лабораторного эксперимента?
Чем сложнее организм, тем труднее это сделать. Для получения генномодифицированных лабораторных организмов такие подходы используются уже давно. Область применения этих методов - генная модификация сельхозкультур, сельскохозяйственных животных, но в особенности бактерий.
Однако перенести разработанные для экспериментальных организмов подходы на человека напрямую невозможно. Методы, которыми работают на животных и растениях, недостаточно специфичны. Часть полученных организмов нежизнеспособны, часть имеет «не те» признаки, их просто выбраковывают. Примером может служить «золотой рис». Его выводили методом генной модификации, добавив к геному риса два гена других организмов, что способствовало накоплению бета-каротина в его семенах. Действительно, был получен рис с заданными характеристиками, но его урожайность оказалась снижена. Предполагается, что причина этого - неудачные места встраивания новых генов.
С человеком цена ошибки слишком высока, поэтому эксперименты на людях очень ограничены. Любые генетические перестройки - риск перерождения клетки в раковую или её гибели. Естественно, можно обрабатывать культуру клеток или, например, колонию бактерий, но в итоге стараются выбирать только те клетки, которые имеют определённые характеристики, являющиеся признаком того, что модификация их генома действительно произошла.
” - Если обрабатывать многоклеточный организм, то в части клеток модификация может пройти, а в части нет. Предсказать, какая из клеток станет впоследствии предшественником конкретных тканей организма, невозможно, поэтому эффект такой модификации сейчас непредсказуем. Условно говоря, клетка, куда встроился ген кареглазости, попадёт в итоге в пятку.
- Можно ли поменять весь геном взрослого человека?
Нет, работать со всеми клетками взрослого человека сейчас невозможно, да и не нужно. Организм, имеющий тяжёлое генетическое нарушение, влияющее на функции каждой клетки, просто погибает пренатально. Совместимые с жизнью генетические нарушения в основном проявляются в каком-то определённом органе или системе органов. Именно они и будут являться мишенями генных инженеров. Если ты хочешь карие глаза, то совершенно необязательно модифицировать ДНК пяток. Отработанных методик таких манипуляций со стабильным предсказуемым результатом на человеке пока нет, но генная инженерия развивается очень быстро, так что ждём!

- Первые опыты по использованию генной инженерии в лечении генетических заболеваний уже есть?
В литературе описан успешный опыт генной терапии булёзного эпидермолиза (редкое хроническое наследственное заболевание, в результате которого непрерывно образуются раны на коже и слизистых оболочках - прим. ред. ). Стволовые клетки кожи пациента обрабатывали вирусоподобными частицами, содержащими нормальную последовательность гена, выведенного из строя мутациями. Полученные клетки заселяли в повреждённые участки кожи ребёнка, и кожные покровы восстанавливались!
Были и попытки влиять на организм взрослого человека. Для этого в оболочку аденовирусной частицы упаковывали нужный генетический материал и с помощью аэрозоля обрабатывали дыхательные пути пациентов. Вирусные частицы прикреплялись к клеткам эпителия и впрыскивали в клетки ДНК «нужного» гена. Проводились и эксперименты по обработке вирусоподобными частицами с «правильными» генами клеток крови пациента.
” - В этих экспериментах результаты тоже были, но нестойкие. Это связано с тем, что изменённые клетки, хоть и производили нужные белки, но не размножались. Постепенно «правильные» клетки умирали, и симптомы заболевания возвращались. Ещё одна проблема такого метода - иммунный ответ организма на эти вирусоподобные частицы. Многие параметры при таком подходе контролировать невозможно, есть угроза повреждения нормального генетического материала клеток.
Поэтому сейчас наиболее перспективное направление - модификация собственных стволовых клеток человека и запуск их обратно в организм. Уже есть методики забора фибробластов из кожи, перевод их обратно в состояние стволовых клеток и перепрограммирование в некоторые другие типы клеток. Это сейчас фактически остриё науки, на это брошено много сил и финансов (правда, не у нас в стране). Выращенные таким образом генетически «подправленные» клетки могут помочь человеку побороть СПИД и некоторые виды рака.
Пересадка собственных митохондрий недавно была использована у новорождённых с сердечно-сосудистыми патологиями в США. Вместо плохо работающего собственного сердца, с разрушенными от кислородного голодания митохондриями, не стали ставить донорское; в повреждённый участок сердечной мышцы вводили митохондрии, полученные из мышечной ткани детей. Клетки сердца захватили митохондрии и начинали работать нормально. В результате из 11 больных детей восьмерым не потребовалась трансплантация сердца! Хотя такую манипуляцию нельзя назвать генно-инженерной, но она создаёт задел для лечения пациентов, в том числе и «чужими» митохондриями.
Вообще в медицине много надежд возлагается именно на использование собственных немного доработанных клеток, и именно в связи с этим, я думаю, будет пересматриваться законодательство в области генной модификации по отношению к человеку.
Беседовала Ирина Ильина
С помощью CRISPR прямо сейчас происходит грандиозный прорыв в генной инженерии: ученые планируют скоро научиться избавлять нас навсегда от любых болезней, с перспективой любых контролируемых мутаций и вечной жизни.
На публикацию этого поста нас натолкнуло видео «CRISPR: редактирование генов изменит все и навсегда», в котором рассказывается о переднем крае науки в части генной модификации человека: речь идет не просто об избавлении от болезней типа СПИД, рак и многие другие, но и о создании безупречного нового вида людей, людей со сверхспособностями и бессмертии. И это происходит прямо сейчас на наших глазах.
Все эти перспективы открываются благодаря недавнему революционному открытию белка CRISPR–Cas9, но обо всем по порядку.
Раньше считалось, что ДНК в каждой нашей клетке — абсолютно идентичны и содержат нашу точную и неизменную копию — какую клетку бы ни взять, но оказалось, что это не так: ДНК в разных клетках немного разные и они меняются в зависимости от разных обстоятельств.

Открытию белка CRISPR — Cas9 помогли наблюдения за выжившими после атаки вирусов бактериями.
Древнейшая война на земле
Бактерии и вирусы соперничают с начала жизни: вирусы-бактериофаги охотятся на бактерии. В океане они убивают 40% от общего числа бактерий каждый день. Вирус делает это, вставляя свой генетический код в бактерию и использует её в качестве фабрики.
Бактерии пытаются безуспешно сопротивляться, но в большинстве случаев их защитные механизмы оказываются слишком слабыми. Но иногда бактерии выживают. Тогда они могут активировать свою самую эффективную противовирусную систему. Они сохраняют часть ДНК вируса в своём генетическом коде, ДНК-архиве «CRISPR». Здесь она хранится до необходимого момента.
Когда вирус снова атакует, бактерия создает РНК-копию из ДНК архива и
заряжает секретное оружие — белок Cas9. Этот протеин сканирует бактерию на предмет вмешательства вируса, сравнивая каждую часть найденного ДНК с архивом. Когда находится 100% соответствие, он активируется и отрезает ДНК вируса, делая его бесполезным, таким образом защищая бактерию.

Белок Cas9 сканирует ДНК клетки на предмет внедрения вируса и заменяет испорченную часть здоровым фрагментом.
Что характерно, Cas9 очень точен, словно ДНК хирург. Переворот произошел, когда ученые поняли, что система CRISPR программируема — можно просто дать копию ДНК, которую нужно изменить, и поместить систему в живую клетку.
Помимо точности, дешевизны и простоты использования, CRISPR позволяет включать и выключать гены живых клеток и изучать конкретные последовательности ДНК.
Этот метод также работает с любыми клетками, микроорганизмами, растениями, животными или людьми.

Ученые выяснили, что Cas9 можно программировать на любые замены в любой части ДНК — и это открывает практически безграничные возможности для человечества.
Болезням конец?
В 2015-м ученые использовали CRISPR для удаления вируса ВИЧ из клеток пациентов,
и доказали, что это возможно
. Годом позже они провели более амбициозный эксперимент с крысами с вирусом ВИЧ в практически всех их клетках.
Учёные просто ввели CRISPR в их хвосты, и смогли удалить более 50% вируса из клеток по всему телу. Возможно, через несколько десятилетий CRISPR поможет избавиться от ВИЧ и других ретровирусов — вирусов, которые прячутся внутри человеческой ДНК, вроде герпеса. Возможно CRISPR сможет победить нашего худшего врага, рак .
Рак является результатом появления клеток, отказывающихся умирать и продолжающих делиться, попутно прячась от иммунной системы. CRISPR дает нам средство редактировать наши иммунные клетки и делать их лучшими охотниками на раковые клетки.
Возможно через некоторое время лечение от рака будет всего лишь парой уколов с несколькими тысячами ваших собственных клеток, созданных в лаборатории, чтобы вылечить вас навсегда.

Возможно через некоторое время вопрос лечения рака — вопрос пары уколов модифицированных клеток.
Первое клиническое испытание такой терапии на пациентах-людях было одобрено в начале 2016-го в США. Менее чем через месяц китайские ученые объявили, что будут лечить пациентов с раком легких иммунными клетками, модифицированными по этой же технологии, в августе 2016 . Дело быстро набирает обороты.
А еще есть генетические заболевания, тысячи их. Они разнятся от слегка раздражающих до крайне смертельных или приносящих годы страданий. С мощными инструментами вроде CRISPR однажды мы сможем покончить с этим.
Более 3000 генетических заболеваний вызываются единственной заменой в ДНК.
Мы уже создаем модифицированную версию Cas9, которая исправляет такие ошибки и избавляет клетку от заболевания. Через пару десятилетий мы может быть сможем навсегда уничтожить тысячи заболеваний. Однако у всех эти медицинских применений один недостаток — они ограничены одним пациентом и умрут вместе с ним, если мы не используем их на репродуктивных клетках или на ранней стадии развития плода.
CRISPR вероятно будет использоваться куда шире. Например для создания модифицированного человека, спроектированного ребенка. Это принесет плавные но необратимые изменения в человеческом генофонде.
Спроектированные дети
Средства изменения ДНК человеческого плода уже существуют,
но технология находится на раннем этапе развития. Однако, ее применяли уже дважды. В 2015-м и 2016-м эксперименты китайских ученых с человеческими эмбрионами достигли частичного успеха на второй попытке.
Они выявили гигантские трудности в редактировании генов эмбрионов, но множество ученых уже работают над решением этих проблем. Это то же самое, что и компьютеры 70-х: в будущем они станут лучше.
Вне зависимости от ваших взглядов на генную инженерию, она коснётся всех. Модифицированные люди могут изменить геном всего нашего вида, потому что их привитые качества будут переданы их детям, и через поколения медленно распространятся, медленно меняя генофонд человечества. Это начнется постепенно.
Первые спроектированные дети не будут сильно отличаться от нас. Скорее всего, их гены будут изменены для избавления от смертельных наследственных заболеваний.
По мере развития технологий все больше людей начнут думать, что неиспользование генетической модификации неэтично, потому что это обрекает детей
на страдание и смерть, которые можно предотвратить.

Как только первый такой ребенок родится, откроется дверь, которую уже не удастся закрыть. Сначала некоторые черты никто не будет трогать, но по мере роста одобрения технологии и наших знаний о генетическом коде, будет расти будет и соблазн.
Если вы сделаете свое потомство иммунным к болезни Альцгеймера, почему бы вдобавок
не дать им улучшенный метаболизм? Почему бы до кучи не наградить их отличным зрением? Как насчет роста или мускул? Пышных волос? Как насчет дара исключительного интеллекта для вашего ребенка?
Огромные перемены придут как результат накопления личных решений миллионов людей.
Это скользкий склон, и модифицированные люди могут стать новой нормой. Пока генная инженерия становится все более привычной, а наши знания улучшаются, мы можем подойти к искоренению главной причины смертности — старения.

2/3 из примерно 150 000 человек, умерших сегодня, умерли по причинам, связанным со старением.
Сегодня считается, что старение вызывается накоплением повреждений в наших клетках
вроде разрывов ДНК или износа систем, ответственных за исправление этих повреждений.
Но есть также и гены, которые напрямую влияют на наше старение.
Генная инженерия и прочая терапия могли бы остановить или замедлить старение. Возможно даже обратить его вспять.

Типичная реакция на возможность вечной жизни (как и любой другой привычной сейчас, но революционной несколько сотен лет назад технологии).
Вечная жизнь и «люди икс»
Мы знаем, что в природе есть животные, которые не стареют. Может, мы могли бы занять у них пару генов. Некоторые ученые считают что однажды старение будет искоренено. Мы все равно будем умирать, но только не в больнице в 90 лет, а через пару тысяч лет, прожитых в окружении наших любимых.
Вызов огромен и, возможно, цель недостижима, но можно допустить, что люди, живущие сегодня, могут оказаться первыми, кто вкусит плоды анти-возрастной терапии. Возможно, нужно всего лишь убедить смышленого миллиардера в необходимости помочь решить эту большую проблему.
Если смотреть на это шире, мы могли бы решить множество задач с помощью специально измененных людей, например которые могли бы лучше справляться с высококалорийной едой, и избавиться от таких недугов цивилизации как ожирение.
Владея модифицированной иммунной системой с перечнем потенциальных угроз,
мы могли бы стать неуязвимыми для большинства заболеваний, преследующих нас сегодня. Ещё позже мы смогли бы создать людей для длительных космических перелетов и для адаптации к различным условиям на других планетах, что было бы крайне полезно для поддержания нашей жизни во враждебной вселенной.
Несколько щепоток соли
Есть несколько главных препятствий, технологических и этических. Многие почувствуют страх перед миром, где мы отсеиваем несовершенных людей, а потомство выбираем на основе того, что считается здоровым.
Но мы уже живем в таком мире. Тесты на десятки генетических заболеваний или осложнений стали нормой для беременных женщин во многих странах. Часто одно подозрение на генетический дефект может привести к прерыванию беременности.
Возьмем для примера синдром Дауна, один из самых распространенных генетических дефектов: в Европе около 90% беременностей с установленным наличием этого отклонения прерываются.

Генетический отбор в действии: уже сейчас синдром Дауна диагностируется на ранней стадии развития эмбриона и 90% беременности с этим диагнозом прерывается.
Решение о прерывании беременности является очень личным, но важно понимать, что мы уже сегодня отбираем людей, основываясь на состоянии здоровья. Нет смысла притворяться, что это изменится, поэтому нам необходимо действовать осторожно и этично, несмотря на растущую свободу выбора благодаря дальнейшему развитию технологий.
Однако, все это перспективы отдаленного будущего. Несмотря на мощность CRISPR, метод не лишен недостатков. Могут случиться ошибки при редактировании, неизвестные ошибки могут произойти в любой части ДНК и остаться незамеченными.
Изменение гена может достичь нужного результата и вылечить от заболевания, но вместе с этим спровоцировать нежелательные изменения. Мы попросту недостаточно знаем о сложных взаимосвязях наших генов, чтобы избежать непредсказуемых последствий.
Работа над точностью и методами наблюдения очень важна в предстоящих клинических испытаниях. И раз уж мы обсудили возможное светлое будущее, также стоит упомянуть и более мрачное видение. Представьте, что может страна вроде Северной Кореи сделать с таким уровнем технологий?

Важно, чтобы технология генной модификации не попала в руки тоталитарным режимам, которые гипотетически могут использовать ее во вред человечеству — например, создать армию генетически модифицированных солдат.
Может она навечно продлить свое правление с помощью принудительной инженерии? Что остановит тоталитарный режим от создания армии модифицированных суперсолдат?
Ведь это в теории возможно. Сценарии вроде этого лежат в далеком будущем, если они вообще возможны, но подтверждение работоспособности концепции такой инженерии уже существует. Технология и правда настолько могущественна.
Подобное может стать поводом для запрета инженерии и связанных с ней исследований, но это определенно было бы ошибкой. Запрет на генную инженерию человека только приведёт науку в области с такими правилами и законами, с которыми нам было бы не по себе. Только участвуя в процессе, мы сможем быть уверены, что исследование ведется с осторожностью, разумом, контролем и прозрачностью.

Мы можем исследовать и внедрять в человека любые генные модификации.
Заключение
Чувствуете беспокойство? Почти в каждом из нас есть какое-то несовершенство. Позволили бы нам существовать в подобном новом мире? Технология несколько устрашает, но нам есть что выиграть, да и генная инженерия может быть очередной ступенью в эволюции разумных видов жизни.
Возможно мы покончим с болезнями, увеличим продолжительность жизни на века и отправимся к звездам. Не стоит мелко мыслить, говоря о такой теме. Каким бы ни было ваше мнение о генной инженерии, будущее наступает несмотря ни на что.
То, что раньше было научной фантастикой, вскоре станет нашей новой реальностью.
Реальностью, полной возможностей и препятствий.
Вы можете также посмотреть непосредственно само видео:
Могут ли полезные или вредные привычки, диеты и занятия спортом отразиться на детях или внуках? Не аукнется ли потомкам наш недосып или лишние бокалы шампанского - вдруг из-за наших неразумных решений у детей проявится склонность к алкоголизму, диабет или синдром запястного канала? Look At Me приводит основные аргументы учёных-генетиков, врачей и других специалистов, которые ответили на этот вопрос в разделе «Ask Science» на Reddit.
Влияет ли образ жизни на ДНК?
Хотя образ жизни не влияет на структуру ДНК, он может оказать воздействие на факторы, которые регулируют активность генов. Это явление называется эпигенетическим наследованием: в зависимости от того, какие факторы влияли на организм в течение жизни, у его потомства могут проявиться или, наоборот, не проявиться некоторые свойства, изначально заложенные в генетический код.
Структура самого генома, передающегося потомку, может быть изменена только во время беременности: плохое питание, стрессы или заболевания, перенесённые матерью в этот период, могут стать причиной мутаций на генном уровне и нарушения структуры ДНК - например, из-за таких мутаций могут родиться дети с лишней хромосомой. Но эти изменения довольно случайны, возникают не всегда и часто не связаны с образом жизни матери. Это генная аномалия, которую трудно предсказать до зачатия, но сегодня будущих родителей могут предупредить с помощью пренатальной диагностики - в программу исследований входит специальный тест, позволяющий проверить плод на 6000 возможных нарушений в развитии.
Однако не все свойства, передающиеся от родителей потомкам, заложены в ДНК. Механизм наследования вне структуры генетического кода изучает специальный раздел науки - эпигенетика. Сам термин был придуман англичанином Конрадом Уоддингтоном в 50-х. Учёный ещё не знал, как устроен геном человека, но догадывался о существовании некоего механизма, который управляет наследственным материалом живых существ. В 1990-е годы, когда был расшифрована ДНК человека, исследователи вспомнили про эпигенетику и нашли подтверждения гипотезам Уоддингтона. Сейчас эпигенетическим (дословно - «надгенным») наследованием называют все изменения, связанные с фенотипом или экспрессией генов, которые проявляются у потомков в первом поколении у живых существ и в нескольких поколениях у клеточных организмов.
учёные не знают, как именно происходит наследование у живых существ. Чтобы отследить причины проявления похожих признаков, нужно учесть бесконечное множество факторов: условия, в которых происходил рост и развитие животного, факторы внешней среды, экологию, космическое излучение и так далее. Исследователи не могут точно сказать, что влияет на экспрессию генов, и если у вас проявляются те же свойства, что у ваших родителей - это не значит, что они передались вам генетически. Возможно, на ваш фенотип влияет климат, ритм жизни в родном городе или потребление продуктов питания, привычных для вашей семьи.
Особенно трудно описать механизм наследования определённых признаков и черт характера у людей - в отличие от большинства животных, люди в своём развитии сильно зависят от социума, и на ребёнка в процессе взросления оказывают воздействие его родственники, сверстники, учителя, герои фильмов, принятые в обществе нормы и порядки. Грубо говоря, если в семье три поколения занимаются спортом, это не значит, что дети наследуют рельефные мышцы генетически: в первую очередь на них влияет воспитание и семейная традиция проводить вечера в спортзале.
Но что если передаваться от поколения к поколению могут не только физиологические характеристики, но и паттерны поведения? Благодаря этому вопросу совсем недавно появилось новое направление - поведенческая эпигенетика. Учёные, работающие в этой сфере, предполагают, что образ жизни родительского организма может повлиять на характер и поведенческие сценарии потомка.
В 2013 году в авторитетном журнале Neuroscience были опубликованы результаты эскпериментов, проведенных на лабораторных мышах: исследователи научили животное бояться запаха вишни (выбор аромата они, кажется, ничем не объясняют), а затем наблюдали проявление такого же страха у потомства этой мыши и даже последующих поколений.
Мы не можем точно знать, что послужило причиной этому: возможно, механизм генетической передачи поведенческих сценариев гораздо более сложен и у мышей проявляется совсем не так, как у людей. Но биологи говорят, что возможность передавать приобретённые навыки генетическим путём была бы неплохим акселератором эволюции, ведь таким образом более совершенные существа появлялись бы значительно быстрее, чем вследствие случайных генных мутаций. Если верить в то, что природа устроена логично, передача паттернов поведения была бы очень кстати для развития живых существ.
но передаются ли потомкам все поведенческие сценарии, или только те, что были полезными для родительского существа? Страх - это проявление инстинкта самосохранения, который помогает мыши защитить себя и будущее популяции, а привычка употреблять алкоголь, например, имеет прямо противоположный эффект. Генетики говорят, что присутствие в генеалогическом древе нескольких страдающих алкоголизмом родственников не увеличивает шансы ребёнка пристраститься к выпивке: скорее всего, в его ДНК будет предрасположенность к алкоголизму, но без побуждающего влияния социальной среды этот ген не проявится.
Получается, что опыт, полученный родителями, всё-таки может повлиять на потомство, но не может изменить ДНК. Так как эпигенетическое наследование открыто совсем недавно, у исследователей не было возможности отследить его на нескольких поколениях людей: сейчас феномен изучают на мышах, структура ДНК которых близка к человеческой, а скорость размножения позволяет отследить экспрессию генов на родителях, детях и внуках. Но вопрос о проецировании результатов экспериментов на людей остаётся открытым.
Занимаясь спортом или соблюдая правильный режим питания, вы не меняете свой генетический код, но используете возможности, заложенные в него природой. Можно сравнить это с игровыми приставками: вставляя разные картриджи, вы получите разные результаты, но без самой консоли с определёнными техническими характеристиками картриджи ничего не значат. В любом случае, заботиться о себе и своём здоровье - неплохая идея, даже если выработанные с таким трудом полезные привычки не передадутся вашим детям эпигенетически.

 Между прочим, технология «убрать плохую ДНК и вставить хорошую» уже реализована на практике! Правда, речь идет не о ядерной ДНК, о которой мы говорили до сих пор, а о митохондриальной. Вот что рассказывает об этом Светлана Михайлова.
Между прочим, технология «убрать плохую ДНК и вставить хорошую» уже реализована на практике! Правда, речь идет не о ядерной ДНК, о которой мы говорили до сих пор, а о митохондриальной. Вот что рассказывает об этом Светлана Михайлова.













