Первая операция по изменению ДНК в организме человека и человеческого эмбриона, точнейшие технологии редактирования генов на основе CRISPR и громкие истории излечения тяжелых наследственных заболеваний. О самых важных последних открытиях в генетике - в материале «Футуриста»
Важнейшее достижение в медицинской генетике - расширяющееся использование технологий редактирования генома человека как для изучения генетических механизмов, контролирующих ранние этапы развития эмбриона, патогенеза наследственных заболеваний, так и для коррекции генетических дефектов. От экспериментов на клеточных линиях и животных в прошлом году перешли к клиническим испытаниям редактирования генома для терапии наследственных болезней на человеке, рассказывает Вера Ижевская, доктор медицинских наук, заместитель директора по научной работе Медико-генетического научного центра РАН.
В США одобрили генную терапию на людях
В августе Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило генную терапию CAR-T против лейкемии у детей. Этот метод заключается в генетической модификации собственных клеток крови пациента. Врачи сначала собирают T-лимфоциты пациента, а затем в лаборатории перепрограммируют их. Затем клетки помещают обратно в тело, где они начинают активнее разрушать раковые клетки. Всего через два месяца ведомство одобрило еще одну CAR-T терапию, на этот раз предназначенную для лечения агрессивной неходжкинской лимфомы у взрослых.
И, наконец, в декабре было получено разрешение на использование Luxturna – терапии, направленной на модификацию одного конкретного гена непосредственно в теле пациента. Этот метод используется при лечении редкой формы унаследованной слепоты – врожденного амавроза Лебера. Это состояние вызывается мутацией в гене RPE65. В каждый глаз пациента вводится инъекция, которая доставляет правильную копию гена RPE65 непосредственно в клетки сетчатки. Однако это лечение очень дорогостоящее: аналитики подозревают , что одна процедура может стоить до 1 миллиона долларов. Подобные процедуры проводили в экспериментальном порядке в Великобритании еще в 2008 году. Тем не менее, одобрение метода на государственном уровне – значимое событие.
Генная терапия восстановила кожу семилетнего мальчика
Кожа ребенка с буллезным эпидермолизом
В ноябре итальянские исследователи объявили , что комбинация генной терапии и лечения с помощью стволовых клеток почти полностью восстановила кожу семилетнего мальчика, страдающего редким наследственным заболеванием – буллезным эпидермолизом. Оно вызывается мутациями в генах LAMA3, LAMB3 и LAMC2, которые отвечают за образование белка ламинина-332. В этом состоянии кожа и слизистые оболочки покрываются болезненными волдырями и становятся чувствительными к незначительным механическим повреждениям.
Исследователи взяли здоровые клетки кожи у пациента, и на их основе вырастили культуры кожи, в которые с помощью ретровирусов ввели здоровую копию гена LAMA3. Модифицированный ген попадал при этом в произвольное место, однако это не нарушило работу других генов. Затем трансгенную кожу привили ребенку на открытые участки дермы. В течение 21 месяца восстановилось около 80% его кожи.
По словам авторов исследования, прогнозы Хассана были очень плохими: он потерял почти весь эпидермис, был истощен и ему постоянно требовался морфин. В течение года перед началом эксперимента он питался через трубку, и поддержание его жизни стоило огромных усилий. Ему пытались пересадить кожу отца и использовать искусственные аналоги, но они не приживались. Сейчас мальчику 9 лет, он ходит в школу и чувствует себя хорошо. Это достижение свидетельствует о возможности лечения генетических заболеваний, которые считались неизлечимыми.
«Генные ножницы» стали гораздо точнее
Технологию CRISPR часто называют " генными ножницами" за ее способность вырезать и вставлять необходимые фрагменты ДНК легче, чем когда-либо прежде. Однако одним из главных препятствий на пути ее использования для лечения человеческих заболеваний являются так называемые внецелевые эффекты – непредусмотренные изменения в геноме после редактирования целевого участка. И все же эту технологию неуклонно совершенствуют. В 2017 году ученые объявили, что теперь с помощью CRISPR можно вносить изменения в РНК – для этого требуется белок Cas13.
Кроме того, в этом году стало широко известно о технологии, способной вносить точечные изменения в ДНК и РНК вместо того, чтобы вырезать и заменять целые фрагменты. Геном человека содержит шесть миллиардов химических оснований – A (аденин), C (цитозин), G (гуанин) и T (тимин). Эти буквы соединяются попарно (A с T, а C с G), образуя двойную спираль ДНК. Стандартные методы редактирования генома, в том числе CRISPR-Cas9, делают двухцепочечные разрывы в ДНК. Однако это слишком грубое решение проблемы, особенно в случаях, когда необходимо исправить точечную мутацию.Технология базового редактирования (ABE) предлагает более эффективный и чистый вариант: она позволяет точечно заменить одну букву в паре на другую. Белок Cas, в технологии CRISPR разрезающий нити ДНК, теперь просто прикрепляется к нужному месту цепочки и приносит с собой другой белок, меняющий одну генетическую букву на другую. ABE не заменяет технологию CRISPR, а является альтернативным вариантом на случай, если требуется внести более тонкие изменения в геном.
ДНК отредактировали прямо в организме человека

Брайан Мадо с невестой перед операцией
В ноябре американские ученые впервые ДНК прямо в теле пациента. Как правило, методы лечения, затрагивающие генетику пациента, основываются на манипуляциях вне человеческого тела. Но в этот раз была использована капельница, которая доставила миллиарды копий корректирующего гена в тело пациента вместе с генетическим инструментом, разрезающим ДНК в нужном месте и освобождающим место для нового гена.
44-летний Брайан Мадо страдает синдромом Хантера – метаболическим заболеванием, при котором углеводы накапливаются в организме из-за недостатка определенных ферментов. До этого эксперимента мужчина перенес уже 26 операций. О результатах процедуры можно будет судить через несколько месяцев: в случае успеха его организм сможет производить необходимый фермент самостоятельно, и ему не придется проходить еженедельную терапию.
"После этого биотехнологическая компания Sangamo Therapeutics начала набор участников клинических испытаний этого метода с гемофилией B, синдромом Гурлера и синдромом Хантера. В случае успешных клинических испытаний появляется надежда на появление эффективных методов лечения наследственных заболеваний, прежде считавшихся неизлечимыми", - комментирует Вера Ижевская.
Первые операции по изменению ДНК эмбриона человека
В сентябре в Китае провели первую в мире операцию по редактированию генома человеческого эмбриона. Исследователи использовали упомянутую выше технологию редактирования базовых оснований ДНК, чтобы излечить бета-талассемию - заболевание, при котором нарушается синтез гемоглобина. Операция проводилась на синтезированных в лаборатории эмбрионах. Чуть позже об экспериментах по редактированию генома эмбриона рассказали шведские ученые.
"Одной из наиболее впечатляющих работ по изменению генома человека является исследование международной группы ученых в США, под руководством Шухрата Миталипова, сообщивших об успешном исправлении мутации гена MYBPC3, приводящей к гипертрофической кардиомиопатии, при редактировании гена эмбрионов человека", - комментирует Вера Ижевская.
Ранее эксперименты проводились на зародышах мышей. Это исследование пролило свет на потенциальное решение проблемы мозаицизма – наличие в тканях генетически различающихся клеток. Если у эмбриона есть две разные копии одного и того же гена, и впоследствии какие-то клетки получают нормальную версию, а какие-то – мутантную, что ведет к различным заболеваниям. Опыты показали, что если ввести CRISPR/Cas-редактор почти одновременно с оплодотворением, то этого можно избежать.
Генетическое тестирование
Одним из ярких инфоповодов уходящего года стала история биохакера Сергея Фаге , который утверждал, что он контролирует свое состояние, опираясь на результаты генетического тестирования. Однако эта методика очень противоречива. Исследование генома человека для определения его происхождения, склонности к тому или иному виду спорта и т.д., - относится к так называемой развлекательной генетике. Их проведение не требует специальной медицинской лицензии, как правило они выполняются коммерческими компаниями. Однако нередко на рынке предлагаются генетические тесты для подтверждения наследственного заболевания у больного, выявления мутаций, которые могут вызвать наследственное заболевание у обследуемого или его детей, тестирования предрасположенности к различным болезням.
"Здесь следует иметь в виду, что современные технологии анализа генома эффективны в первых двух случаях, касающихся мутаций, которые вызывают редкие наследственные заболевания. Что касается тестирования предрасположенности к частым заболеваниям (сердечно-сосудистым, диабету и т.д.), то они имеют невысокое прогностическое значение и их результаты часто сопровождаются общими рекомендациями о необходимости вести здоровый образ жизни. В любом случае, генетическое тестирование с медицинскими целями должно быть назначено врачом, до него пациенту должно быть врачом-генетиком объяснено, что он может получить в результате тестирования, заключение также дает врач-генетик. Из этого следует, что учреждение, которое выполняет такие тесты, должно иметь медицинскую лицензию по специальностям "генетика" и "лабораторная генетика" и соответствующий штат квалифицированных специалистов", - объясняет Вера Ижевская.
Что делать пациенту с этой дорогостоящей информацией, далеко не всегда понятно.
Дженнифер Дудна — известная ученая из США, труды которой в основном посвящены структурной биологии и биохимии. Дженнифер лауреатка многих престижных премий, в 1985 году получила степень бакалавра, а уже в 89 году стала доктором философии в Гарвардском университете. С 2002 года работает в Калифорнийском университете в Беркли. Широкую известность получила как исследователь РНК-интерференции и CRISPR. Исследования по Cas9 проводила вместе с Эммануэль Шарпантье.
00:12
Несколько лет назад мы с моей коллегой Эммануэль Шарпентье изобрели новую технологию редактирования геномов. Она называется CRISPR-Cas9. Технология CRISPR позволяет учёным вносить изменения в ДНК внутри клеток, что может дать нам возможность вылечивать генетические заболевания.
00:31
Возможно, вам будет интересно узнать, что технология CRISPR возникла в рамках проекта фундаментальных исследований, целью которого было выяснение того, как бактерии борются с вирусными инфекциями. Бактериям приходится сталкиваться с вирусами в среде своего обитания, и вирусную инфекцию можно представить как тикающую бомбу замедленного действия: у бактерии есть всего несколько минут, чтобы её обезвредить до того как бактерия будет разрушена. В клетках многих бактерий существует адаптивная иммунная система - CRISPR, позволяющая им выявлять и разрушать вирусную ДНК.
01:04
В состав системы CRISPR входит белок Cas9, который способен искать, расщеплять и в конечном итоге уничтожать вирусную ДНК особым способом. И именно в ходе нашего исследования по изучению активности этого белка, Cas9, мы поняли, что можем использовать его активность в генно-инженерной технологии, которая позволит учёным удалять и вставлять фрагменты ДНК внутрь клеток с невероятной точностью, что позволило бы делать то, что ранее было просто невозможно.
01:42
Технология CRISPR уже используется для изменения ДНК в клетках мышей и обезьян, а также других организмов. Недавно китайские учёные показали, что им удалось использовать технологию CRISPR даже для изменения генов эмбрионов человека. Учёные из Филадельфии показали возможность применения CRISPR для удаления ДНК интегрировавшегося вируса ВИЧ из инфицированных клеток человека.
02:09
Возможность осуществлять редактирование генома таким образом также вызывает различные этические вопросы, которые следует иметь в виду, потому что технологию можно применять не только к клеткам взрослых, но также и к эмбрионам разных организмов, в том числе и нашего вида. Таким образом, вместе с коллегами мы начали международное обсуждение изобретённой нами технологии, чтобы иметь возможность учесть все этические и общественные проблемы, связанные с подобными технологиями.
02:39
А сейчас я хочу рассказать вам, что такое технология CRISPR, что она позволяет делать, на каком мы сейчас этапе и почему я считаю, что нам нужно с осторожностью продвигаться вперёд по пути применения этой технологии.
02:54
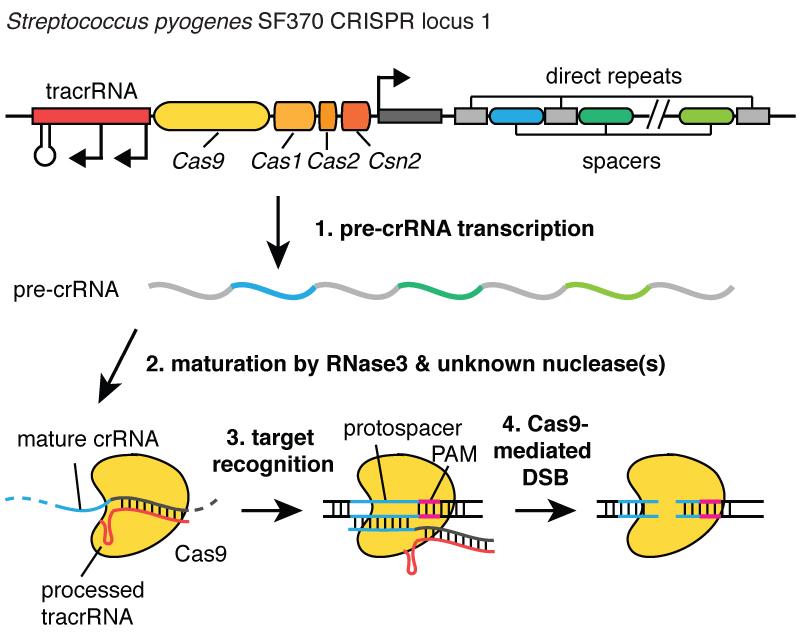
Когда вирусы инфицируют клетку, они впрыскивают свою ДНК. И внутри бактерии система CRISPR позволяет выдернуть эту ДНК из вируса и вставить её маленькие фрагменты в хромосому - в ДНК бактерии. И эти фрагменты вирусной ДНК вставляются в область, называемую CRISPR. CRISPR означает «короткие палиндромные повторы, регулярно расположенные группами». (Смех)
03:24
Длинновато. Теперь вы понимаете, почему мы используем акроним CRISPR. Это механизм, позволяющий клеткам регистрировать с течением времени вирусы, которые их заражали. И важно отметить, что эти фрагменты ДНК передаются потомкам клеток, так что клетки защищены от вирусов не в течение одного поколения, а в течение многих поколений клеток. Это позволяет клеткам сохранять «записи» об инфекции, и как говорит мой коллега Блейк Виденхефт, локус CRISPR - это фактически карточка генетической вакцинации клеток. После встраивания этих фрагментов ДНК в бактериальную хромосому клетка делает маленькую копию в виде молекулы, называемой РНК, на этом рисунке она оранжевая, и это точный отпечаток вирусной ДНК. РНК - химическая «кузина» ДНК, что позволяет ей взаимодействовать с молекулами ДНК, имеющими подходящую для неё последовательность.
04:24
Итак, эти маленькие фрагменты РНК, образованные с локуса CRISPR, ассоциируют, связываются с белком под названием Cas9, на этом рисунке он белый, и образуется комплекс, который выполняет в клетке функции часового. Он просматривает всю ДНК в клетке, чтобы найти участки, соответствующие последовательностям связанных с ним РНК. И когда эти участки найдены, как можно видеть на рисунке, где ДНК - это синяя молекула, этот комплекс связывается с этой ДНК и даёт белку Cas9 разрезать вирусную ДНК. Он очень точно вносит разрыв. Мы можем рассматривать этого часового, комплекс белка Cas9 и РНК, как пару ножниц, которые могут разрезать ДНК, - он делает двуцепочечный разрыв в спирали ДНК. И важно, что этот комплекс можно запрограммировать, например, можно его запрограммировать узнавать нужные последовательности ДНК и разрезать ДНК в на этом участке.
05:26
Как я собираюсь вам рассказать, мы поняли, что эту активность можно использовать в генной инженерии, чтобы позволить клеткам вносить очень точные изменения в ДНК на участке, где был сделан данный разрез. Это примерно как использование программы, обрабатывающей слова, для исправления опечаток в документе.
05:48
Мы смогли предположить, что систему CRISPR можно использовать в геномной инженерии, поскольку клетки способны находить разорванную ДНК и восстанавливать её. Итак, когда клетка растения или животного находит двуцепочечный разрыв в своей ДНК, она способна его устранить, либо соединяя разорванные концы ДНК, внося незначительное изменение в последовательность в этом месте, либо она может устранить разрыв, вставив новый участок ДНК в место разрыва. Таким образом, если мы можем вносить двуцепочечные разрывы в ДНК в строго определённых местах, мы можем заставить клетки восстанавливать эти разрывы, при этом либо разрушая генетическую информацию, либо внося новую. И если бы мы смогли запрограммировать технологию CRISPR таким образом, чтобы разрыв в ДНК вносился в положении мутации или рядом с мутацией, вызывающей, например, муковисцидоз, мы могли бы заставить клетки исправить эту мутацию.
06:51
Вообще-то, геномная инженерия - не новая область, она развивается с 1970-х годов. У нас есть технологии для секвенирования ДНК, для копирования ДНК, даже для манипуляций с ДНК. И это весьма многообещающие технологии, но проблема в том, что они были либо неэффективны, либо слишком сложны в использовании, поэтому большинство учёных не могли использовать их в своих лабораториях или применять в клинических условиях. Таким образом, существовала потребность в такой технологии как CRISPR, потому что она относительно проста в использовании. Старые технологии геномной инженерии можно представить себе как необходимость перемонтировать ваш компьютер каждый раз, когда вы хотите запустить новую программу, тогда как технология CRISPR - это что-то вроде программного обеспечения для генома: мы легко можем её программировать, используя маленькие фрагменты РНК.
07:53
Как только сделан двуцепочечный разрыв, мы можем вызвать процесс восстановления и тем самым, возможно, достичь поразительных результатов, например, исправлять мутации, вызывающие серповидноклеточную анемию или болезнь Хантингтона. Лично я считаю, что первые случаи применения технологии CRISPR будут связаны с кровью, где относительно просто доставлять этот инструмент внутрь клеток, по сравнению с плотными тканями.
08:22
Прямо сейчас во многих проводимых работах метод применяют в животных моделях болезней человека, например, на мышах. Технологию используют для внесения очень точных изменений, что позволяет нам изучать то, как эти изменения клеточной ДНК влияют либо на ткань, либо, как здесь, на целый организм.
08:42
В этом примере технологию CRISPR использовали для разрушения гена путём внесения небольшого изменения в ДНК в гене, который отвечает за чёрную окраску шерсти этих мышей. Представьте, эти белые мышата отличаются от своих окрашенных братьев и сестёр всего только небольшим изменением одного гена во всём геноме, а в остальном они абсолютно нормальны. И когда мы секвенируем ДНК этих животных, то обнаруживаем, что изменение в ДНК произошло именно в том месте, где мы планировали, используя технологию CRISPR.
09:18
Также проводятся эксперименты и на других животных, у которых удобно создавать модели болезней человека, например, на обезьянах. И в этом случае мы обнаруживаем, что эти системы можно использовать для тестирования применения данной технологии к определённым тканям, например, для выяснения того, как доставлять инструмент CRISPR в клетки. Мы также хотим расширить наше понимание того, как можно контролировать способ восстановления ДНК после её разрыва, и выяснить, как можно контролировать и ограничивать нецелевое воздействие, или непреднамеренные эффекты, при использовании этой технологии.
09:55
Я полагаю, что мы станем свидетелями использования данной технологии в клинике, разумеется, у взрослых пациентов, в течение следующих 10 лет. Мне кажется вероятным, что за этот период будут проведены клинические исследования и, возможно, даже одобрены методы терапии, что очень воодушевляет. И благодаря этому воодушевлению, которое вызывает технология, к ней проявляют огромный интерес стартап-компании, созданные для того, чтобы превратить технологию CRISPR в коммерческий продукт, а также многие венчурные капиталисты,
10:26
инвестирующие в такие компании. Но мы также должны учитывать, что технологию CRISPR можно использовать для улучшения характеристик. Представьте, что мы могли бы попробовать конструировать людей, обладающих улучшенными характеристиками, например, более прочными костями, или меньшей склонностью к сердечно-сосудистым заболеваниям, или даже обладающих свойствами, которые, возможно, показались бы нам желательными, такими как другой цвет глаз или более высокий рост, что-то вроде этого. Если хотите, это «дизайнерские люди». Сейчас практически отсутствует генетическая информация, позволяющая понять, какие гены отвечают за эти признаки. Но важно понимать, что технология CRISPR дала нам инструмент для внесения таких изменений,
11:13
как только эти знания станут нам доступны. Это поднимает ряд этических вопросов, которые мы должны тщательно рассмотреть. И именно поэтому мы с коллегами призвали учёных всего мира сделать паузу в любых клинических применениях технологии CRISPR у эмбрионов человека, чтобы у нас было время тщательно рассмотреть все возможные последствия этого. И у нас есть важный прецедент для того, чтобы объявить такую паузу: в 1970-х годах учёные объединились для провозглашения моратория на использование молекулярного клонирования,
11:47
пока не будет тщательно проверена и подтверждена безопасность этой технологии. Так что пока генная инженерия людей откладывается, но это уже не научная фантастика. Созданные генной инженерией животные и растения уже существуют. И это накладывает на всех нас большую ответственность и необходимость учитывать как нежелательные последствия, так и роль преднамеренного влияния этого научного прорыва.
12:21
Спасибо!
12:22
(Аплодисменты) (Аплодисменты закончились)
Бруно Джуссани: Дженнифер, эта технология может иметь огромные последствия, как вы подчёркивали. Мы очень уважаем вашу позицию по объявлению паузы, или моратория, или карантина. У всего этого, конечно, есть терапевтические последствия, но есть и не связанные с лечением, и, по-видимому, именно они наиболее сильно притягивают интерес, особенно в СМИ. Вот один из последних выпусков журнала Economist: «Редактирование человечества». Здесь рассказывается только об улучшении свойств, не о лечении. Какую реакцию вы получили в марте от своих коллег в научном сообществе, когда попросили или предложили сделать паузу и задуматься обо всём этом?
Дженнифер Дудна: Мне кажется, коллеги были рады возможности открыто это обсудить. Интересно, что когда я разговаривала об этом с людьми, мои коллеги-учёные и не только высказывали самые разные точки зрения на этот счёт. Очевидно, что эта тема требует тщательного рассмотрения и обсуждения.
БДж: В декабре будет большая встреча, которую вы с коллегами созываете вместе с Национальной академией наук и другими. Чего именно вы ожидаете от этой встречи, с практической точки зрения?
ДжД : Я надеюсь, что будут обнародованы точки зрения многих людей и заинтересованных сторон, желающих ответственно обдумать использование этой технологии. Возможно, достигнуть консенсуса не удастся, но я полагаю, что мы должны по крайней мере понять, с какими проблемами столкнёмся в будущем.
БДж: Ваши коллеги, например, Джордж Чёрч из Гарварда, говорят: «Этические проблемы в основном являются вопросом безопасности. Мы снова и снова проводим тесты на животных, в лабораториях, и когда чувствуем, что опасности нет, переходим на человека». Это другой подход: мы должны использовать эту возможность и не должны останавливаться. Может ли это вызвать раскол в научном сообществе? То есть мы увидим, что часть людей отступят, потому что сомневаются в этичности, а другие просто пойдут вперёд, так как в некоторых странах контроль слабый или его вообще нет.
ДжД : Мне кажется, на любую новую технологию, особенно такую как эта, будет несколько разных точек зрения, и я думаю, что это абсолютно понятно. Полагаю, в конце концов эту технологию будут использовать для конструирования генома человека, но мне кажется, что делать это без тщательного рассмотрения и обсуждения рисков и возможных осложнений было бы безответственно.
БДж: Есть много технологий и других областей науки, которые развиваются по экспоненте, фактически как в вашей области. Я имею в виду искусственный интеллект, автономных роботов и так далее. Нигде, как мне кажется, кроме области автономных военных роботов, никто не инициировал аналогичную дискуссию в этих областях, призвав к мораторию. Не считаете ли вы, что ваша дискуссия может стать примером для других областей?
ДжД: Мне кажется, учёным сложно покидать лабораторию. Если говорить обо мне, мне не очень комфортно это делать. Но я действительно считаю, что раз я участвую в разработке этого, то данный факт накладывает на меня и моих коллег ответственность. И я бы сказала, что надеюсь, что другие технологии будут рассматриваться так же, как мы хотели бы рассматривать нечто, способное оказывать влияние в других областях, отличных от биологии.
15:44
БДж:
Дженнифер, спасибо за то, что пришли на TED.
ДжД : Спасибо!
Эпигенетика: не гены правят человеком, а человек – генами эпигенетикаЭпигенетика - относительно новая отрасль генетики, которую называют одним из наиболее важных биологических открытий с момента обнаружения ДНК. Раньше считалось, что набор генов, с которым мы рождаемся, необратимо определяет нашу жизнь. Однако теперь известно, что гены можно «включать» и «выключать», а также добиться их большей или меньшей экспрессии под воздействием различных факторов образа жизни. Estet-portal.com расскажет, что такое эпигенетика, как она работает, и что Вы можете сделать, чтобы повысить шансы на выигрыш в «лотерею здоровья».
Эпигенетика: изменения в образе жизни - ключ к изменению генов
Эпигенетика - наука, которая изучает процессы, приводящие к изменению активности генов без изменения последовательности ДНК. Проще говоря, эпигенетика изучает воздействие внешних факторов на активность генов.
В ходе проекта «Геном человека» было идентифицировано 25,000 генов в человеческой ДНК. ДНК можно назвать кодом, который организм использует для построения и перестройки самого себя. Однако генам и самим нужны «инструкции», по которым они определяют необходимые действия и время их выполнения.
Эпигенетические модификации и являются теми самыми инструкциями. Существует несколько видов таких модификаций, однако двумя основными из них являются те, которые затрагивают метильные группы (углерод и водород) и гистоны (белки).
Чтобы понять, как работают модификации, представим, что ген - это лампочка. Метильные группы действуют в роли выключателя света (т.е. гена), а гистоны - в качестве регулятора силы света (т.е. они регулируют уровень активности генов). Так вот, считается, что у человека есть четыре миллиона таких выключателей, которые приводятся в действие под влиянием образа жизни и внешних факторов.
Ключом к пониманию влияния внешних факторов на активность генов стали наблюдения за жизнью однояйцевых близнецов. Наблюдения показали, насколько сильными могут быть изменения в генах таких близнецов, ведущих разный образ жизни в разных внешних условиях. По идее, у однояйцевых близнецов болезни должны быть «общими», однако зачастую это не так: алкоголизм, болезнь Альцгеймера, биполярное расстройство, шизофрения, диабет, рак, болезнь Крона и ревматоидный артрит могут проявляться только у одного близнеца в зависимости от различных факторов. Причиной этого является эпигенетический дрифт - возрастное изменение экспрессии генов.
Секреты эпигенетики: как факторы образа жизни влияют на гены
Исследования в области эпигенетики показали, что только 5% генных мутаций, связанных с болезнями, являются полностью детерминированными; на остальные 95% можно повлиять посредством питания, поведения и прочих факторов внешней среды. Программа здорового образа жизни позволяет изменить активность от 4000 до 5000 различных генов.
Мы не просто являемся суммой генов, с которыми были рождены. Именно человек является пользователем, именно он управляет своими генами. При этом не столь важно, какие «генетические карты» раздала Вам природа - важно, что Вы с ними будете делать.
Эпигенетика находится на начальной стадии развития, многое еще предстоит узнать, однако существуют сведения о том, какие основные факторы образа жизни влияют на экспрессию генов.
- Питание, сон и упражнения
Не удивительно, что питание способно влиять на состояние ДНК. Рацион, насыщенный переработанными углеводами, приводит к «атакам» ДНК высокими уровнями глюкозы в крови. С другой стороны, обратить повреждения ДНК могут:
- сульфорафан (содержится в брокколи);
- куркумин (в составе куркумы);
- эпигаллокатехин-3-галлат (есть в зеленом чае);
- ресвератрол (содержится в винограде и вине).
Что касается сна, всего неделя недосыпа негативно сказывается на активности более 700 генов. На экспрессии генов (117) положительно сказываются занятия спортом.
- Стресс, отношения и даже мысли
Эпигенетики утверждают, что не только такие «материальные» факторы, как диета, сон и спорт, влияют на гены. Как оказывается, стресс, отношения с людьми и Ваши мысли тоже являются весомыми факторами, влияющими на экспрессию генов. Так:
- медитация подавляет экспрессию провоспалительных генов, помогая бороться с воспалениями, т.е. защититься от болезни Альцгеймера, рака, болезней сердца и диабета; при этом эффект такой практики виден уже через 8 часов занятий;
- 400 научных исследований показали, что проявление благодарности, доброта, оптимизм и различные техники, которые задействуют разум и тело, положительно влияют на экспрессию генов;
- отсутствие активности, плохое питание, постоянные негативные эмоции, токсины и вредные привычки, а также травмы и стрессы запускают негативные эпигенетичекие изменения.
Длительность результатов эпигенетических изменений и будущее эпигенетики
Одним из наиболее потрясающих и противоречивых открытий является то, что эпигенетические изменения передаются следующим поколениям без изменения последовательности генов. Доктор Митчелл Гейнор, автор книги «План генной терапии: Возьмите генетическую судьбу под контроль при помощи питания и образа жизни», считает, что экспрессия генов также передается по наследству.
Эпигенетика, считает доктор Рэнди Джиртл, доказывает, что мы также несем ответственность за целостность нашего генома. Раньше мы считали, что от генов зависит все. Эпигенетика позволяет понять, что наше поведение и привычки могут повлиять на экспрессию генов у будущих поколений.
Эпигенетика - сложная наука, которая имеет огромный потенциал. Специалистам предстоит проделать еще много работы, чтобы определить, какие именно факторы окружающей среды влияют на наши гены, как мы можем (и можем ли) обратить заболевания вспять или максимально эффективно их предотвратить.
Когда время от времени в СМИ появляются публикации о чудесном исцелении от смертельного заболевания с помощью самовнушения, специальной диеты, биоэнергетики или какого-либо другого нетрадиционного метода, на лицах врачей и ученых, как правило, появляются скептические улыбки.
Даже когда речь идет о неоспоримых фактах, подтвержденных современными методами исследования, традиционная медицина либо отмахивается от них, либо пытается объяснить неожиданное выздоровление больного ошибкой в первоначальном диагнозе.
Однако американский генетик Брюс Липтон утверждает, что с помощью истинной веры, исключительно силой мысли человек и в самом деле способен избавиться от любой болезни. И никакой мистики в этом нет: исследования Липтона показали, что направленное психическое воздействие способно менять... генетический код организма.
«Эффект плацебо никто не отменял»
На протяжении многих лет Брюс Липтон специализировался в области генной инженерии, успешно защитил докторскую диссертацию, стал автором ряда исследований. Все это время Липтон, как и многие генетики и биохимики, верил, что человек является неким биороботом, жизнь которого подчинена программе, записанной в его генах.
Брюс Липтон
Гены с этой точки зрения определяют практически все: особенности внешнего облика, способности и темперамент, предрасположенность к тем или иным заболеваниям и, в конечном счете, продолжительность жизни. Никто не может изменить свой личный генетический код, а значит, нам остается лишь смириться с тем, что предопределено природой.
Поворотным моментом во взглядах доктора Липтона стали проводимые им в конце 1980-х годов эксперименты по изучению особенностей поведения клеточной мембраны. До того в науке считалось, что именно гены, находящиеся в ядре клетки, определяют, что следует пропустить через эту мембрану, а что - нет. Однако опыты Липтона показали, что внешние воздействия на клетку могут влиять на поведение генов и даже приводить к изменению их структуры.
Оставалось лишь понять, можно ли производить такие изменения с помощью психических процессов, или, проще говоря, силой мысли.
В сущности, я не придумал ничего нового, - говорит доктор Липтон. - На протяжении столетий медикам известен эффект плацебо - когда больному предлагают нейтральное вещество, утверждая, что это лекарство. В итоге вещество и в самом деле оказывает исцеляющее действие. Но, как ни странно, научного объяснения этому явлению до сих пор не было.
Мое открытие позволило дать такое объяснение: с помощью веры в целебную силу лекарства человек меняет идущие в его организме процессы, в том числе и на молекулярном уровне. Он может «отключать» одни гены, заставлять «включаться» другие и даже менять свой генетический код.
Вслед за этим я подумал о различных случаях чудесного исцеления. Врачи от них всегда отмахивались. Но на самом деле, даже если бы у нас был всего один такой случай, он должен был заставить врачей задуматься над его природой.
Мы все спешим за чудесами...
Академическая наука приняла эти взгляды Брюса Липтона в штыки. Однако он продолжил свои исследования, в ходе которых последовательно доказывал, что без всяких лекарств вполне можно влиять на генетическую систему организма.

В том числе, кстати, и с помощью специально подобранной диеты. Так, для одного из своих экспериментов Липтон вывел породу желтых мышей с врожденными генетическими дефектами, обрекающими их потомство на избыточный вес и короткую жизнь. Затем с помощью специальной диеты он добился того, что эти мыши стали давать потомство, не похожее на родителей - обычного цвета, худых и живущих столько же, сколько и остальные их сородичи.
Все это, согласитесь, отдает лысенковщиной, и потому негативное отношение академических ученых к идеям Липтона предугадать было нетрудно. Тем не менее он продолжил эксперименты и доказал, что аналогичного воздействия на гены можно добиться и с помощью, скажем, воздействия сильного экстрасенса или путем определенных физических упражнений. Научное направление, изучающее влияние внешних воздействий на генетический код, получило название «эпигенетика».
И все же главным воздействием, способным менять состояние нашего здоровья, Липтон считает именно силу мысли, то, что происходит не вокруг, а внутри нас.
Давно известно, что у двух людей может быть одинаковая генетическая предрасположенность к раку, - заявляет Липтон. - Но у одного болезнь проявилась, а у другого - нет. Почему? Да потому, что они жили по-разному: один чаще испытывал стрессы, чем второй; у них были разные самооценка и самоощущение, различный ход мыслей. Сегодня я могу утверждать, что мы способны управлять нашей биологической природой; мы можем с помощью мысли, веры и устремлений влиять на наши гены.
Великое отличие человека от остальных существ на Земле как раз и заключается в том, что он может менять свое тело, исцелять сам себя от смертельных болезней и даже избавляться от наследственных заболеваний, давая на это психические установки организму. Мы вовсе не обязаны быть жертвами нашего генетического кода и обстоятельств жизни.
Поверьте в то, что вы можете исцелиться, - и вы вылечитесь от любого заболевания. На первый взгляд, все предельно просто. Но только на первый взгляд...
Когда сознания маловато...
Если бы все было так просто, то большинство людей с легкостью решали бы любые проблемы со здоровьем с помощью произнесения незамысловатых мантр вроде «Я могу исцелиться от этого недуга», «Я верю, что мой организм в состоянии сам исцелиться»...
Но ничего этого не случается, да и, как поясняет Липтон, не может происходить, если психические установки проникают только в область сознания, определяющего лишь 5% нашей психической деятельности, не затрагивая оставшиеся 95% - подсознание. Проще говоря, лишь единицы из тех, кто поверил в возможность самоисцеления силами своего мозга, на самом деле действительно в это верят - и потому добиваются успеха. Большинство же на уровне подсознания отрицают такую возможность.

Еще точнее: само их подсознание, которое, собственно говоря, на автоматическом уровне и контролирует все процессы в нашем организме, отвергает такую возможность. При этом оно (опять-таки на уровне автоматизма) обычно руководствуется принципом, что вероятность того, что с нами произойдет нечто позитивное, куда меньше, чем дальнейшее протекание событий по наихудшему варианту.
Согласно Липтону, именно на такой лад наше подсознание начинает настраиваться в период раннего детства, с рождения до шести лет, когда самые незначительные события, намеренно или случайно сказанные взрослыми слова, наказания, травмы формируют «опыт подсознания» и в итоге - личность человека. Причем сама природа нашей психики устроена так, что все плохое, происходящее с нами, откладывается в подсознание куда легче, нежели память о приятных и радостных событиях.
В результате «опыт подсознания» у подавляющего большинства людей на 70% состоит из «негатива» и лишь на 30% - из «позитива». Таким образом, чтобы действительно добиться самоисцеления, необходимо, по меньшей мере, изменить это соотношение на прямо противоположное. Только таким образом можно сломать барьер, установленный подсознанием на пути вторжения силы нашей мысли в клеточные процессы и генетический код.
По мнению Липтона, работа многих экстрасенсов как раз и заключается в сломе этого барьера. Но он предполагает, что аналогичного эффекта можно добиться и с помощью гипноза, и другими методами. Однако большая часть этих методов все еще ждет своего открытия. Или просто широкого признания.
После произошедшего для Липтона около четверти века назад мировоззренческого переворота ученый продолжил свои исследования в области генетики, но одновременно стал одним из активных организаторов различных международных форумов с целью наведения мостов между традиционной и альтернативной медициной.

На организованных им конгрессах и семинарах известные психологи, врачи, биофизики и биохимики сидят рядом со всевозможными народными целителями, экстрасенсами и даже теми, кто называет себя магами или колдунами. При этом последние обычно демонстрируют собравшимся свои возможности, а ученые устраивают мозговой штурм для попытки их научного объяснения.
А заодно продумывают будущие эксперименты, которые помогли бы выявить и объяснить механизм скрытых резервов нашего организма.
Именно в таком симбиозе эзотерики и современных методов лечения с главной опорой на возможности психики самого пациента, или, если угодно, магии и науки, видит Брюс Липтон основной путь дальнейшего развития медицины. А прав он или нет, покажет время.
Ян СМЕЛЯНСКИЙ
Генная инженерия человека нам, простым обывателям, все еще кажется чем-то из области научной фантастики. Тем неожиданней было сообщение издания «The Telegraph», в котором говорилось, что Совет по этике в Великобритании разрешил генную инженерию человеческих эмбрионов. Понятно, что от рекомендаций Совета по этике до закона о генетических вмешательствах «дистанция огромного размера», однако первый шаг, похоже, сделан.
« The Telegraph» обратился за комментарием к профессору Карен Юнг, председателю рабочей группы по редактированию генома и воспроизводству человека. Госпожа профессор заявила, что в будущем в числе репродуктивных технологий может оказаться и внесение наследуемых изменений генома для обеспечения определенных характеристик детей. Сперва, разумеется, таким способом будут бороться с наследственными заболеваниями, но потом «если технология будет успешно развиваться, у нее есть потенциал стать альтернативной репродуктивной стратегией, доступной родителям для достижения более широкого круга целей».
На вопрос, можно ли использовать генетическое редактирование, чтобы дети были высокими, со светлыми волосами и голубыми глазами (ну, если вдруг именно такая внешность будет в моде), профессор Йонг добавила что и этого она тоже не исключает…
Но у нас возник не этический, а, если так можно выразиться, технический вопрос: неужели ученые уже в состоянии переделать нам геном и заменить голубые глаза на карие?
Что такое геном человека (для тех, кто прогулял уроки биологии)
Вся наша жизнь закодирована в молекулах ДНК - дезоксирибонуклеиновой кислоты. Удивительно, но все эти огромные молекулы состоят из комбинации всего лишь четырех основных элементов: азотистых оснований аденина, гуанина, тимина и цитозина (их обычно для краткости обозначают первыми буквами - A, G, T, C). Сложные последовательности этих элементов служат своеобразными матрицами, на которых синтезируются РНК - рибонуклеиновые кислоты. РНК - «рабочие лошадки» нашего организма, у каждой - своя специализация. Одни участвуют в синтезе белков, задавая верную последовательность элементов, другие поставляют аминокислоты к месту синтеза белков, третьи - «перекраивают» своих собратьев, катализируя реакции с участием РНК.
” Лично мне наш геном напоминает муравейник: с ДНК - муравьиной королевой, бесконечно откладывающей яйца, из которых появляются РНК-муравьи, среди которых есть солдаты, няньки, рабочие…
А в Википедии приводят такой пример: «ДНК нередко сравнивают с чертежами для изготовления белков. Развивая эту инженерно-производственную аналогию, можно сказать, что, если ДНК — это полный набор чертежей для изготовления белков, находящийся на хранении в сейфе директора завода, то матричная РНК — временная рабочая копия чертежа отдельной детали, выдаваемая в сборочный цех».
Выбирайте аналогию по своему вкусу!
Молекулы ДНК есть в любой клетке нашего организма, в которой есть ядро. Молекулы - потому что знаменитые спирали ДНК «нарублены» на 46 различных по размеру «кусков», соединенных попарно - это 23 пары наших хромосом.
” В каждой паре хромосом одна досталась нам от отца, а другая от матери. 23-я пара отвечает за наш пол, поэтому хромосомы в ней могут отличаться: «ХХ» - у девочек, «ХУ» - у мальчиков.
Во всех аутосомах (не-половых хромосомах) и хромосома, доставшаяся от папы, и доставшаяся от мамы, содержат подобные гены на одних и тех же участках. Подобные - поскольку гены, у всех нас, вообще говоря, разные. К примеру, на участке, где располагается ген, ответственный за цвет волос, в одной хромосоме из пары окажется ген мамы-блондинки, а на другой - папы-брюнета. В таком случае один из генов будет доминировать, а второй, рецессивный, ждать своего часа. Если именно его передадут по наследству, и если в паре с ним окажется такой же рецессивный ген, то у него будет возможность проявить себя.
” Этот принцип наследования генетической информации чреват неприятными сюрпризами. И мы сейчас вовсе не о рождении голубоглазого блондина в семье кареглазых брюнетов, а о наследственных заболеваниях. Порой, скрытые в рецессивных генах, они дремлют во многих поколениях, никак не проявляя себя внешне. Но стоит такому гену встретиться со своим «собратом», и трагические последствия неизбежны.
Любые родители хотели бы вырезать зловредный ген из своей ДНК и заменить его на здоровый, обезопасив потомков. И тут мы снова возвращаемся к вопросу: неужели это реально?
Генная инженерия и ЭКО
Светлана Владимировна, генетический анализ во время проведения экстракорпорального оплодотворения, «зачатия в пробирке», вещь уже привычная?
” -Доказано, что такое «отщипывание» клеток не приводит к нарушению развития зародыша. Этот метод технически гораздо сложнее и дороже, чем просто генетический анализ плода во время беременности, который проводится после забора амниотической жидкости или фрагмента плаценты, поэтому широкого распространения пока не получил.
То есть, родителям остается только уповать, что однажды случайным образом «выпадет» комбинация здоровых генов. А нельзя ли как-то вырезать «плохие» гены?
Ген удалять в большинстве случаев не надо, собственно, патогенные мутации как раз «удаляют» ген функционально. Надо заставить неправильно функционирующий ген работать нормально. Либо вырезать из него лишнее, либо вставить потерянное, либо заменить неправильное на правильное. Более простой подход - одним махом добавить в геном нормальную копию гена.
|
Своя собственная ДНК есть у митохондрий - органелл, отвечающих за «энергоснабжение» клетки. В отличие от остальных хромосом, находящихся в ядре, митохондриальные ДНК - это небольшие кольцевые молекулы, их количество в клетке варьирует от десятков до тысяч копий и зависит от возраста. Яйцеклетка богата митохондриями, а сперматозоид содержит всего одну, обеспечивающую движение его «хвостика». После оплодотворения эта митохондрия уничтожается, поэтому все митохондриальные гены человека достаются ему только от матери. Если причина заболевания находится в митохондриальной ДНК, то возможно использование митохондрий «третьего родителя». При этом ядро яйцеклетки матери, имеющей патогенные мутации, пересаживают в цитоплазму яйцеклетки женщины с нормальными митохондриями, а потом оплодотворяют её сперматозоидами отца и подсаживают по протоколу ЭКО. В частности, метод цитоплазматической замены успешно использовался в случае материнского бесплодия, связанного с нарушениями в митохондриальной ДНК. С 2015 г. этот метод генетической «модификации» человека легализован в Великобритании, но по-прежнему запрещён в США. Законодательство Австралии готовится к новшествам относительно генной инженерии. Чтобы обойти существующие запреты, такие манипуляции проводят на территории стран, где нет соответствующего законодательства, например в Мексике и на Украине.
|
Технологии изменения ДНК человека
- Но как можно «оперировать» ген, неужели речь идет о реальных технологиях?
Есть много способов разрезать молекулу ДНК. Инструменты для этого люди позаимствовали у бактерий. Борясь за место под солнцем (или, наоборот, в тени) бактерии синтезируют белки или комплексы белков и РНК, которые разрезают ДНК других видов бактерий и вирусов, но безвредны для ДНК хозяйки и её потомков. Эти молекулы прикрепляются к специфическим последовательностям ДНК (специфической фразе из «букв» А, С, T и G), которых заведомо нет в геноме хозяйки. Так что «отщипнуть» - не проблема, главное - правильно сшить обратно разрезанную молекулу. Если этого не сделать, то произойдёт разрыв хромосомы и нарушение функций того участка, где находится разрыв.
” - Сейчас наиболее перспективным орудием генного инженера считается бактериальная система CRISPR /Cas9 - часть иммунитета бактерий, модификации которой активно используют для редактирования геномов эукариот (живых организмов, клетки которых содержат ядра - прим. ред.). Бактерии «держат про запас» у себя в геноме фрагменты ДНК вирусов, с которыми они сталкивались раньше. Эти фрагменты позволяют бактерии быстро строить конструкции, состоящие из РНК и белков, которые специфически разрезают ДНК вирусов. При этом белок Cas9 функционирует как молекулярные ножницы, а так называемая gРНК, частично содержащая генетическую последовательность вируса, - это система GPS-навигации, которая направляет «ножницы» на специфический район ДНК. Бактерии борются с генами вирусов, но такой биотехнологический инструмент можно нацелить на произвольный участок ДНК любого организма.
Чтобы клетка, ДНК которой разрезали таким способом, смогла восстановиться, в неё параллельно вводят ДНК с нужной последовательностью. Клетка запускает собственные механизмы починки ДНК и использует добавленную ДНК как матрицу для починки полученного повреждения. Таким образом, можно поменять одну генетическую последовательность на другую!

- Где же берут «правильные» гены?
Практически любой ген человека можно вставить в геном бактерии, заставить эту бактерию активно делиться, а потом снова выделить нужный фрагмент в большом количестве. Так, сложные животные белки уже давно не выделяют из органов животных, а нарабатывают с помощью встроенных в бактерии генов (например, инсулин).
Может ли генная инженерия подарить здоровье и карие глаза
- То есть, генная инженерия возможна - пусть и в порядке лабораторного эксперимента?
Чем сложнее организм, тем труднее это сделать. Для получения генномодифицированных лабораторных организмов такие подходы используются уже давно. Область применения этих методов - генная модификация сельхозкультур, сельскохозяйственных животных, но в особенности бактерий.
Однако перенести разработанные для экспериментальных организмов подходы на человека напрямую невозможно. Методы, которыми работают на животных и растениях, недостаточно специфичны. Часть полученных организмов нежизнеспособны, часть имеет «не те» признаки, их просто выбраковывают. Примером может служить «золотой рис». Его выводили методом генной модификации, добавив к геному риса два гена других организмов, что способствовало накоплению бета-каротина в его семенах. Действительно, был получен рис с заданными характеристиками, но его урожайность оказалась снижена. Предполагается, что причина этого - неудачные места встраивания новых генов.
С человеком цена ошибки слишком высока, поэтому эксперименты на людях очень ограничены. Любые генетические перестройки - риск перерождения клетки в раковую или её гибели. Естественно, можно обрабатывать культуру клеток или, например, колонию бактерий, но в итоге стараются выбирать только те клетки, которые имеют определённые характеристики, являющиеся признаком того, что модификация их генома действительно произошла.
” - Если обрабатывать многоклеточный организм, то в части клеток модификация может пройти, а в части нет. Предсказать, какая из клеток станет впоследствии предшественником конкретных тканей организма, невозможно, поэтому эффект такой модификации сейчас непредсказуем. Условно говоря, клетка, куда встроился ген кареглазости, попадёт в итоге в пятку.
- Можно ли поменять весь геном взрослого человека?
Нет, работать со всеми клетками взрослого человека сейчас невозможно, да и не нужно. Организм, имеющий тяжёлое генетическое нарушение, влияющее на функции каждой клетки, просто погибает пренатально. Совместимые с жизнью генетические нарушения в основном проявляются в каком-то определённом органе или системе органов. Именно они и будут являться мишенями генных инженеров. Если ты хочешь карие глаза, то совершенно необязательно модифицировать ДНК пяток. Отработанных методик таких манипуляций со стабильным предсказуемым результатом на человеке пока нет, но генная инженерия развивается очень быстро, так что ждём!

- Первые опыты по использованию генной инженерии в лечении генетических заболеваний уже есть?
В литературе описан успешный опыт генной терапии булёзного эпидермолиза (редкое хроническое наследственное заболевание, в результате которого непрерывно образуются раны на коже и слизистых оболочках - прим. ред. ). Стволовые клетки кожи пациента обрабатывали вирусоподобными частицами, содержащими нормальную последовательность гена, выведенного из строя мутациями. Полученные клетки заселяли в повреждённые участки кожи ребёнка, и кожные покровы восстанавливались!
Были и попытки влиять на организм взрослого человека. Для этого в оболочку аденовирусной частицы упаковывали нужный генетический материал и с помощью аэрозоля обрабатывали дыхательные пути пациентов. Вирусные частицы прикреплялись к клеткам эпителия и впрыскивали в клетки ДНК «нужного» гена. Проводились и эксперименты по обработке вирусоподобными частицами с «правильными» генами клеток крови пациента.
” - В этих экспериментах результаты тоже были, но нестойкие. Это связано с тем, что изменённые клетки, хоть и производили нужные белки, но не размножались. Постепенно «правильные» клетки умирали, и симптомы заболевания возвращались. Ещё одна проблема такого метода - иммунный ответ организма на эти вирусоподобные частицы. Многие параметры при таком подходе контролировать невозможно, есть угроза повреждения нормального генетического материала клеток.
Поэтому сейчас наиболее перспективное направление - модификация собственных стволовых клеток человека и запуск их обратно в организм. Уже есть методики забора фибробластов из кожи, перевод их обратно в состояние стволовых клеток и перепрограммирование в некоторые другие типы клеток. Это сейчас фактически остриё науки, на это брошено много сил и финансов (правда, не у нас в стране). Выращенные таким образом генетически «подправленные» клетки могут помочь человеку побороть СПИД и некоторые виды рака.
Пересадка собственных митохондрий недавно была использована у новорождённых с сердечно-сосудистыми патологиями в США. Вместо плохо работающего собственного сердца, с разрушенными от кислородного голодания митохондриями, не стали ставить донорское; в повреждённый участок сердечной мышцы вводили митохондрии, полученные из мышечной ткани детей. Клетки сердца захватили митохондрии и начинали работать нормально. В результате из 11 больных детей восьмерым не потребовалась трансплантация сердца! Хотя такую манипуляцию нельзя назвать генно-инженерной, но она создаёт задел для лечения пациентов, в том числе и «чужими» митохондриями.
Вообще в медицине много надежд возлагается именно на использование собственных немного доработанных клеток, и именно в связи с этим, я думаю, будет пересматриваться законодательство в области генной модификации по отношению к человеку.
Беседовала Ирина Ильина

 Между прочим, технология «убрать плохую ДНК и вставить хорошую» уже реализована на практике! Правда, речь идет не о ядерной ДНК, о которой мы говорили до сих пор, а о митохондриальной. Вот что рассказывает об этом Светлана Михайлова.
Между прочим, технология «убрать плохую ДНК и вставить хорошую» уже реализована на практике! Правда, речь идет не о ядерной ДНК, о которой мы говорили до сих пор, а о митохондриальной. Вот что рассказывает об этом Светлана Михайлова.










